Органическая химия
Органи́ческая хи́мия, наука, предметом изучения которой являются соединения углерода с другими элементами – т. н. органические соединения, а также законы их превращений; часть химии. Как органические классифицируются не все соединения углерода. Например, СО2, HCN, CS2 традиционно относят к неорганическим. Органические соединения играют важнейшую роль в процессах построения и жизнедеятельности растительных и животных организмов. Самое разнообразное применение органические соединения находят во всех сферах жизнедеятельности человека: из органических соединений состоят пища, топливо, лекарства, моющие средства, красители, взрывчатые вещества, материалы, без которых невозможно создание транспорта, книгопечатание, освоение космоса и др.
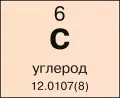 Углерод, химический элемент с атомным номером 6 и атомной массой 12,0107(8).Многообразие органических соединений обусловлено уникальной способностью атомов углерода соединяться друг с другом простыми и кратными связями, образовывать молекулы, включающие практически неограниченное число атомов, связанных в цепи, циклы, бициклы, трициклы, полициклы, каркасы и другие, образовывать прочные связи со многими элементами периодической системы, а также явлением изомерии – существованием разных по структуре и свойствам соединений, обладающих одним и тем же составом и одинаковой молекулярной массой. Число известных органических соединений превышает 50 млн (не учитывая комбинаторные библиотеки) и увеличивается каждый год на 250–300 тыс. Многообразие и огромное число органических соединений определяют значение органической химии как крупнейшего раздела современной химии.
Углерод, химический элемент с атомным номером 6 и атомной массой 12,0107(8).Многообразие органических соединений обусловлено уникальной способностью атомов углерода соединяться друг с другом простыми и кратными связями, образовывать молекулы, включающие практически неограниченное число атомов, связанных в цепи, циклы, бициклы, трициклы, полициклы, каркасы и другие, образовывать прочные связи со многими элементами периодической системы, а также явлением изомерии – существованием разных по структуре и свойствам соединений, обладающих одним и тем же составом и одинаковой молекулярной массой. Число известных органических соединений превышает 50 млн (не учитывая комбинаторные библиотеки) и увеличивается каждый год на 250–300 тыс. Многообразие и огромное число органических соединений определяют значение органической химии как крупнейшего раздела современной химии.
Основным методом органической химии является синтез. Развитие методов синтеза не только способствовало установлению строения самых сложных соединений (идеальным завершением процесса определения структуры молекул органических соединений является полный, или тотальный, синтез, т. е. получение с помощью однозначных химических методов соединения, структура которого была предложена на основании изучения другими методами), но и привело к созданию материальных объектов, никогда ранее не существовавших в природе. Для успешного проведения органического синтеза химику-синтетику необходимо совершенное сочетание теоретических и практических знаний с интуитивным подбором средств, наиболее подходящих для построения самых сложных молекул.
Современная органическая химия изучает соединения, выделяемые из растительных и животных организмов (природные вещества), а также соединения, созданные искусственно с помощью лабораторного или промышленного органического синтеза. Более того, объектами изучения компьютерной органической химии являются соединения, не только не существующие в живых организмах, но и такие, которые, по-видимому, нельзя синтезировать (например, гипотетический аналог метана, имеющий не природное тетраэдрическое строение, а форму плоского квадрата, в центре которого лежит атом С, а в вершинах – атомы H).
Органический синтез связывает органическую химию с химической промышленностью как малотоннажной (тонкий органический синтез – производство лекарств, витаминов, жидких кристаллов, ферментов, феромонов и др.), так и крупнотоннажной (основной органический синтез – производство искусственного волокна и пластмасс, нефтехимический синтез – химическая переработка нефти и газа и др.).
Строение органических соединений устанавливают с помощью методов анализа органических соединений, включающих, помимо элементного анализа, такие физические методы, как ЯМР, масс-спектрометрия, инфракрасная и ультрафиолетовая спектроскопия, рентгеновский структурный анализ, электронография и др. Развиваются также методы выделения, очистки и разделения органических веществ, например различные виды хроматографии.
Историческая справка
Истоки органической химии восходят к глубокой древности (уже тогда знали о спиртовом и уксуснокислом брожении, крашении индиго и ализарином). Однако в Средние века (период алхимии) были известны лишь немногие индивидуальные органические соединения. Все исследования этого периода сводились главным образом к операциям, при помощи которых, как тогда думали, одни простые вещества можно превратить в другие. Начиная с 16 в. (период ятрохимии) исследования были направлены в основном на получение и использование различных лекарственных веществ: был выделен из растений ряд эфирных масел, приготовлен диэтиловый эфир, сухой перегонкой древесины получены древесный (метиловый) спирт и уксусная кислота, из винного камня – винная кислота, перегонкой янтаря – янтарная кислота. Большая роль в становлении органической химии принадлежит А. Л. де Лавуазье, который разработал основные количественные методы определения состава химических соединений.
 Уно Троили. Портрет Йёнса Якоба Берцелиуса. 1843. По картине Улофа Юхана Сёдермарка.
Национальный музей Швеции, Стокгольм.Название «органическое соединение» встречается уже в конце 18 в. Термин «органическая химия» был, по-видимому, впервые применён Й. Я. Берцелиусом в «Руководстве по органической химии», изданном в 1827 г. В термине «органическая химия» нашли отражение взгляды того времени на органические соединения как вещества, встречающиеся только в растительных и животных организмах (от греч. ὀργανιϰος, букв. – относящийся к органам); образование органических веществ рассматривалось как проявление «жизненной силы». Это заблуждение опровергли Ф. Вёлер, который впервые получил органическое вещество – мочевину из неорганического – цианата аммония (1828), Г. Кольбе, синтезировавший уксусную кислоту (1845), М. Бертло, получивший аналоги природных жиров и синтезировавший метан из H2S и CS2 (1854), и др.
Уно Троили. Портрет Йёнса Якоба Берцелиуса. 1843. По картине Улофа Юхана Сёдермарка.
Национальный музей Швеции, Стокгольм.Название «органическое соединение» встречается уже в конце 18 в. Термин «органическая химия» был, по-видимому, впервые применён Й. Я. Берцелиусом в «Руководстве по органической химии», изданном в 1827 г. В термине «органическая химия» нашли отражение взгляды того времени на органические соединения как вещества, встречающиеся только в растительных и животных организмах (от греч. ὀργανιϰος, букв. – относящийся к органам); образование органических веществ рассматривалось как проявление «жизненной силы». Это заблуждение опровергли Ф. Вёлер, который впервые получил органическое вещество – мочевину из неорганического – цианата аммония (1828), Г. Кольбе, синтезировавший уксусную кислоту (1845), М. Бертло, получивший аналоги природных жиров и синтезировавший метан из H2S и CS2 (1854), и др.
 Юстус фон Либих. Австрийская национальная библиотека, Вена.В 1-й половине 19 в. накоплен обширный опытный материал и сделаны первые обобщения, определившие бурное развитие органической химии: развиты методы анализа органических соединений (Й. Я. Берцелиус, Л. Ж. Тенар, Ю. фон Либих, Ж.-Б. Дюма, М.-Э. Шеврёль; принципы этих методов лежат в основе современного анализа органических веществ), создана теория радикалов (Ф. Вёлер, Ж. Л. Гей-Люссак, Ю. фон Либих, Ж.-Б. Дюма) как групп атомов, переходящих неизменными из исходной молекулы в конечную в процессе реакции; развита теория типов (Ш. Ф. Жерар, 1851), согласно которой органические соединения можно конструировать из неорганических веществ четырёх типов (водорода, воды, хлороводорода, аммиака) замещением в них атомов на органические фрагменты; введено понятие изомерии (Й. Я. Берцелиус, 1830).
Юстус фон Либих. Австрийская национальная библиотека, Вена.В 1-й половине 19 в. накоплен обширный опытный материал и сделаны первые обобщения, определившие бурное развитие органической химии: развиты методы анализа органических соединений (Й. Я. Берцелиус, Л. Ж. Тенар, Ю. фон Либих, Ж.-Б. Дюма, М.-Э. Шеврёль; принципы этих методов лежат в основе современного анализа органических веществ), создана теория радикалов (Ф. Вёлер, Ж. Л. Гей-Люссак, Ю. фон Либих, Ж.-Б. Дюма) как групп атомов, переходящих неизменными из исходной молекулы в конечную в процессе реакции; развита теория типов (Ш. Ф. Жерар, 1851), согласно которой органические соединения можно конструировать из неорганических веществ четырёх типов (водорода, воды, хлороводорода, аммиака) замещением в них атомов на органические фрагменты; введено понятие изомерии (Й. Я. Берцелиус, 1830).
 Генрих фон Ангели. Портрет Фридриха Кекуле. 1890.Исследования Э. Франклендом металлоорганических соединений позволили установить четырёхвалентность углерода, заложить основы теории валентности (Э. Франкленд, Ф. А. Кекуле, Г. Кольбе, 1850–1860-е гг.) и постулировать существование углерод-углеродных простых и двойных связей. Революционный вклад внёс А. С. Купер (1858), который ввёл понятие валентного штриха. С тех пор химики используют язык конституционных (структурных) формул молекул органических соединений, в которых связи между отдельными атомами обозначаются с помощью одного (простая связь), двух (двойная) или трёх (тройная) валентных штрихов.
Генрих фон Ангели. Портрет Фридриха Кекуле. 1890.Исследования Э. Франклендом металлоорганических соединений позволили установить четырёхвалентность углерода, заложить основы теории валентности (Э. Франкленд, Ф. А. Кекуле, Г. Кольбе, 1850–1860-е гг.) и постулировать существование углерод-углеродных простых и двойных связей. Революционный вклад внёс А. С. Купер (1858), который ввёл понятие валентного штриха. С тех пор химики используют язык конституционных (структурных) формул молекул органических соединений, в которых связи между отдельными атомами обозначаются с помощью одного (простая связь), двух (двойная) или трёх (тройная) валентных штрихов.
Одновременно продолжалось интенсивное развитие синтетических методов. Впервые создаются промышленные производства органических соединений [А. В. фон Гофман, У. Г. Перкин (старший) – синтетические красители: мовеин, фуксин, цианиновые и азокрасители]. Усовершенствование открытого Н. Н. Зининым (1842) способа синтеза анилина послужило основой создания отечественной анилинокрасочной промышленности. В лаборатории А. Байера синтезированы природные красители – индиго, ализарин, индигоидные, ксантеновые, антрахиноновые.
 Портрет Александра Бутлерова. 1842.Идея неразрывной связи химических и физических свойств молекулы с её строением и единственности этого строения впервые высказана А. М. Бутлеровым (1861), который создал классическую теорию химического строения (атомы в молекулах соединяются согласно их валентностям, химические и физические свойства соединений определяются природой и числом входящих в их состав атомов, а также типом связей и взаимным влиянием непосредственно не связанных атомов). Теория химического строения определила дальнейшее бурное развитие органической химии: в 1865 г. Ф. А. Кекуле предложил формулу бензола, позднее высказал идею об осцилляции связей; В. В. Марковников и А. М. Зайцев сформулировали ряд правил, впервые связавших направление химической реакции с химическим строением вступающего в реакцию вещества. Экспериментальные данные Й. Вислиценуса (1873) об идентичности структурных формул природных молочных кислот послужили толчком для создания стереохимической теории (Я. Х. Вант-Гофф и Ж. А. Ле Бель, 1874), в которой постулировалось тетраэдрическое строение фрагмента с четырёхвалентным атомом углерода, что в случае четырёх различных заместителей предсказывало существование пространственно-зеркальных изомеров; для соединений с двойной связью (тетраэдры соединяются по ребру) – наличие геометрической изомерии. На этой основе возникла стереохимия – наука о трёхмерной ориентации атомов в молекулах и вытекающих отсюда следствиях, касающихся свойств соединений. Работами А. Байера, К. Лаара, Л. Клайзена, Л. Кнорра развиты представления о таутомерии – подвижной изомерии.
Портрет Александра Бутлерова. 1842.Идея неразрывной связи химических и физических свойств молекулы с её строением и единственности этого строения впервые высказана А. М. Бутлеровым (1861), который создал классическую теорию химического строения (атомы в молекулах соединяются согласно их валентностям, химические и физические свойства соединений определяются природой и числом входящих в их состав атомов, а также типом связей и взаимным влиянием непосредственно не связанных атомов). Теория химического строения определила дальнейшее бурное развитие органической химии: в 1865 г. Ф. А. Кекуле предложил формулу бензола, позднее высказал идею об осцилляции связей; В. В. Марковников и А. М. Зайцев сформулировали ряд правил, впервые связавших направление химической реакции с химическим строением вступающего в реакцию вещества. Экспериментальные данные Й. Вислиценуса (1873) об идентичности структурных формул природных молочных кислот послужили толчком для создания стереохимической теории (Я. Х. Вант-Гофф и Ж. А. Ле Бель, 1874), в которой постулировалось тетраэдрическое строение фрагмента с четырёхвалентным атомом углерода, что в случае четырёх различных заместителей предсказывало существование пространственно-зеркальных изомеров; для соединений с двойной связью (тетраэдры соединяются по ребру) – наличие геометрической изомерии. На этой основе возникла стереохимия – наука о трёхмерной ориентации атомов в молекулах и вытекающих отсюда следствиях, касающихся свойств соединений. Работами А. Байера, К. Лаара, Л. Клайзена, Л. Кнорра развиты представления о таутомерии – подвижной изомерии.
 Шарль Адольф Вюрц. Фото: Th. Truchelot & Valkman.Все эти теоретические представления способствовали мощному развитию синтетической органической химии. К концу 19 в. были синтезированы все важнейшие представители углеводородов, спиртов, альдегидов, кетонов, карбоновых кислот, галогено- и нитропроизводных, азот- и серосодержащих структур, гетероциклов ароматической природы. Разработаны методы получения диенов, ацетиленов и алленов (А. Е. Фаворский). Открыты многочисленные реакции конденсации [Ш. А. Вюрц, А. П. Бородин, У. Г. Перкин (старший), Л. Клайзен, А. Михаэль, Ш. Фридель, Дж. М. Крафтс, Э. Кнёвенагель и др.]. Исключительные успехи были достигнуты Э. Фишером в изучении углеводов, белков и пуринов, в использовании ферментов в органическом синтезе, им же осуществлён синтез полипептидов. Основой промышленности душистых веществ становятся работы О. Валлаха по химии терпенов. Выдающимися даже для 21 в. являются пионерские работы Р. Вильштеттера (установление структуры кокаина и хлорофилла). Фундаментальный вклад в развитие органического синтеза внесён В. Гриньяром и Н. Д. Зелинским – создание исключительно плодотворного метода синтеза магнийорганических соединений и открытие каталитических превращений углеводородов; последнее сыграло выдающуюся роль в развитии нефтехимии.
Шарль Адольф Вюрц. Фото: Th. Truchelot & Valkman.Все эти теоретические представления способствовали мощному развитию синтетической органической химии. К концу 19 в. были синтезированы все важнейшие представители углеводородов, спиртов, альдегидов, кетонов, карбоновых кислот, галогено- и нитропроизводных, азот- и серосодержащих структур, гетероциклов ароматической природы. Разработаны методы получения диенов, ацетиленов и алленов (А. Е. Фаворский). Открыты многочисленные реакции конденсации [Ш. А. Вюрц, А. П. Бородин, У. Г. Перкин (старший), Л. Клайзен, А. Михаэль, Ш. Фридель, Дж. М. Крафтс, Э. Кнёвенагель и др.]. Исключительные успехи были достигнуты Э. Фишером в изучении углеводов, белков и пуринов, в использовании ферментов в органическом синтезе, им же осуществлён синтез полипептидов. Основой промышленности душистых веществ становятся работы О. Валлаха по химии терпенов. Выдающимися даже для 21 в. являются пионерские работы Р. Вильштеттера (установление структуры кокаина и хлорофилла). Фундаментальный вклад в развитие органического синтеза внесён В. Гриньяром и Н. Д. Зелинским – создание исключительно плодотворного метода синтеза магнийорганических соединений и открытие каталитических превращений углеводородов; последнее сыграло выдающуюся роль в развитии нефтехимии. 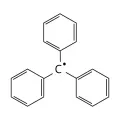 Трифенилметильный радикал.Химия свободных радикалов началась с работ М. Гомберга, открывшего (1900) трифенилметильный радикал, и была продолжена работами А. Е. Чичибабина, Г. Виланда и Ш. Гольдшмидта.
Трифенилметильный радикал.Химия свободных радикалов началась с работ М. Гомберга, открывшего (1900) трифенилметильный радикал, и была продолжена работами А. Е. Чичибабина, Г. Виланда и Ш. Гольдшмидта.
Разработка Ф. Преглем в начале 20 в. методов микроанализа органических веществ способствовала дальнейшему быстрому развитию химии природных соединений, что ознаменовалось работами Г. Виланда по установлению природы жёлчных кислот (1910), А. Виндауса – природы холестерина (1913–1915), работами Х. Фишера по синтезу таких ключевых соединений, как порфирин, гемин и билирубин (1927–1931), У. Н. Хоуорса по установлению структуры углеводов, синтезу витамина С (1915–1933), П. Каррера, Р. Куна по получению каротиноидов и витаминов В₂, В₆, Е и K (1911–1939). Химия алкалоидов, половых гормонов, терпенов создана работами А. Бутенандта (1929–1961), Л. Ружички (1930-е гг.), А. П. Орехова и Р. Робинсона.
 Георг Виттиг. 1979.К середине 20 в. органический синтез претерпевает бурное развитие. Это определялось открытием таких основополагающих процессов, как получение олефинов с использованием илидов (Г. Виттиг, 1954), диеновый синтез (О. Дильс, К. Альдер, 1928), гидроборирование ненасыщенных соединений (Г. Ч. Браун, 1959), синтез нуклеотидов и синтез гена (А. Р. Тодд, X. Г. Корана). Не менее значительны успехи в химии металлоорганических соединений (А. Н. Несмеянов, Г. А. Разуваев). В 1920–1930-х гг. А. Е. Арбузов создаёт основы химии фосфорорганических соединений, что впоследствии привело к открытию новых типов физиологически активных соединений, боевых отравляющих веществ, инсектицидов, комплексонов и др. В 1951 г. осуществлён синтез ферроцена, установление сэндвичевой структуры которого Р. Б. Вудвордом и Дж. Уилкинсоном в 1952 г. положило начало химии металлоценовых соединений и химии органических соединений переходных металлов. В 1955 г. Э. О. Фишер синтезировал дибензолхром и разработал метод синтеза ареновых производных переходных металлов. В 1960-х гг. немецкий химик Г. Шилл осуществил синтез таких «неклассических» соединений, как катенаны и ротаксаны. В 1960–1980-х гг. Ч. Педерсен, Д. Дж. Крам и Ж.-М. Лен разрабатывают химию краун-эфиров, криптандов, каликсаренов и других родственных структур, способных образовывать прочные молекулярные комплексы, и тем самым подходят к важнейшей проблеме молекулярного распознавания. В 20 в. на стыке органической химии с неорганической химией и биохимией возникли биоорганическая химия, бионеорганическая химия, супрамолекулярная химия, широко использующие методы и представления органической химии.
Георг Виттиг. 1979.К середине 20 в. органический синтез претерпевает бурное развитие. Это определялось открытием таких основополагающих процессов, как получение олефинов с использованием илидов (Г. Виттиг, 1954), диеновый синтез (О. Дильс, К. Альдер, 1928), гидроборирование ненасыщенных соединений (Г. Ч. Браун, 1959), синтез нуклеотидов и синтез гена (А. Р. Тодд, X. Г. Корана). Не менее значительны успехи в химии металлоорганических соединений (А. Н. Несмеянов, Г. А. Разуваев). В 1920–1930-х гг. А. Е. Арбузов создаёт основы химии фосфорорганических соединений, что впоследствии привело к открытию новых типов физиологически активных соединений, боевых отравляющих веществ, инсектицидов, комплексонов и др. В 1951 г. осуществлён синтез ферроцена, установление сэндвичевой структуры которого Р. Б. Вудвордом и Дж. Уилкинсоном в 1952 г. положило начало химии металлоценовых соединений и химии органических соединений переходных металлов. В 1955 г. Э. О. Фишер синтезировал дибензолхром и разработал метод синтеза ареновых производных переходных металлов. В 1960-х гг. немецкий химик Г. Шилл осуществил синтез таких «неклассических» соединений, как катенаны и ротаксаны. В 1960–1980-х гг. Ч. Педерсен, Д. Дж. Крам и Ж.-М. Лен разрабатывают химию краун-эфиров, криптандов, каликсаренов и других родственных структур, способных образовывать прочные молекулярные комплексы, и тем самым подходят к важнейшей проблеме молекулярного распознавания. В 20 в. на стыке органической химии с неорганической химией и биохимией возникли биоорганическая химия, бионеорганическая химия, супрамолекулярная химия, широко использующие методы и представления органической химии.
Развитие современной органической химии достигло уровня, позволяющего начать решение такой основополагающей её проблемы, как проблема количественного соотношения структуры вещества и его свойства, в качестве которого может выступать любое физическое свойство (например, температура плавления), биологическая активность любого строго заданного типа (например, пестицидная) и др. Решение задач такого типа осуществляется с использованием математических методов. Развитие этих методов в начале 21 в. позволило подойти к решению обратной задачи предсказания химических структур с заранее заданным конкретным свойством (см., например, Молекулярный дизайн). Органическая химия является фундаментальной основой таких дисциплин, как фармакология и медицинская химия, компьютерный синтез и математическая химия, биоинженерия, судебная химия и др.
Классификация органических соединений
Основу органических соединений составляет незамкнутая (открытая) или замкнутая цепь углеродных атомов; одно или несколько звеньев цепи может быть заменено на атомы, отличные от углерода, – гетероатомы, чаще всего О, N, S. По структуре органические соединения подразделяют на алифатические соединения (углеводороды и их производные, имеющие открытую углеродную цепь); карбоциклические, в том числе алициклические соединения и ароматические соединения (имеют замкнутую углеродную цепь); гетероциклические соединения (циклы включают, наряду с атомами углерода, один или несколько гетероатомов). Углеводороды и их производные, не содержащие кратных связей, относятся к насыщенным соединениям, с кратными связями – к ненасыщенным.
 Классификация углеводородов.От каждого углеводорода путём замены атомов Н на различные характеристические (функциональные) группы может быть образован т. н. генетический ряд, например генетический ряд этана C2H6: этилхлорид C2H5Cl – этанол C2H5OH – этиламин C2H5NH2 – ацетальдегид CH3CHO – уксусная кислота CH3COOH и т. д. В зависимости от типа функциональной группы органические соединения подразделяются на классы: углеводороды RH (функциональная группа отсутствует), галогенпроизводные углеводородов RHal (Hal – галоген), спирты ROH, альдегиды RCHO, кетоны R2CO, карбоновые кислоты RCOOH, первичные, вторичные и третичные амины RNH2, R2NH и R3N, нитросоединения RNO2; тиолы (меркаптаны) RSH, органические сульфиды R2S и др. К функциональным группам относят также кратные углерод-углеродные связи. Последовательности органических соединений с однотипной структурой и одинаковыми функциональными группами, в случае если соединения отличаются друг от друга по количеству структурных единиц СН2 в углеродной цепи, составляют гомологические ряды.
Классификация углеводородов.От каждого углеводорода путём замены атомов Н на различные характеристические (функциональные) группы может быть образован т. н. генетический ряд, например генетический ряд этана C2H6: этилхлорид C2H5Cl – этанол C2H5OH – этиламин C2H5NH2 – ацетальдегид CH3CHO – уксусная кислота CH3COOH и т. д. В зависимости от типа функциональной группы органические соединения подразделяются на классы: углеводороды RH (функциональная группа отсутствует), галогенпроизводные углеводородов RHal (Hal – галоген), спирты ROH, альдегиды RCHO, кетоны R2CO, карбоновые кислоты RCOOH, первичные, вторичные и третичные амины RNH2, R2NH и R3N, нитросоединения RNO2; тиолы (меркаптаны) RSH, органические сульфиды R2S и др. К функциональным группам относят также кратные углерод-углеродные связи. Последовательности органических соединений с однотипной структурой и одинаковыми функциональными группами, в случае если соединения отличаются друг от друга по количеству структурных единиц СН2 в углеродной цепи, составляют гомологические ряды.
По величине молекул органические соединения подразделяют на низкомолекулярные (с молекулярной массой от нескольких десятков до нескольких сотен, редко до тысячи) и высокомолекулярные (макромолекулярные; с молекулярной массой порядка 104–106 и более). Химия высокомолекулярных соединений составляет отдельный раздел органической химии.
Соединения, в молекулах которых кроме атомов С, Н, Hal, О, N, S содержатся атомы других элементов, образующих связи с углеродом, относятся к элементоорганическим соединениям.
Строение органических соединений
Для органических соединений характерны неполярные ковалентные связи С−С и полярные ковалентные связи С−О, С−N, С−Hal, С−металл и т. д. Образование ковалентных связей было объяснено на основании развитых Г. Н. Льюисом и В. Косселем (1916) предположений о важной роли электронных образований – октетов и дублетов. Молекула устойчива, если валентная оболочка таких элементов, как С, N, О, Hal, содержит 8 электронов (правило октета), а валентная оболочка водорода – 2 электрона. Химическая связь образуется обобществлённой парой электронов различных атомов (простая связь). Двойные и тройные связи образуются соответственно двумя и тремя такими парами. Электроотрицательные атомы (F, О, N) используют для связи с углеродом не все свои валентные электроны; «неиспользованные» электроны образуют неподелённые (свободные) электронные пары. Полярность и поляризуемость ковалентных связей в органических соединениях в электронной теории Льюиса – Косселя объясняется смещением электронных пар от менее электроотрицательного к более электроотрицательному атому, что находит выражение в индуктивном и мезомерном эффектах. Признание ключевой роли электронных пар сыграло важную роль в классификации органических соединений: реагенты с чётным числом валентных электронов подразделили на нуклеофильные и электрофильные реагенты, реакции частиц с нечётным числом валентных электронов назвали радикальными.
Классическая теория химического строения и первоначальные электронные представления оказались не в состоянии удовлетворительно описать на языке структурных формул строение многих соединений, например ароматических. Современная теория связи в органических соединениях основана главным образом на понятии орбиталей и использует метод молекулярных орбиталей. Интенсивно развиваются квантовохимические методы, объективность которых определяется тем, что в их основе лежит аппарат квантовой механики, единственно пригодный для изучения явлений микромира. Метод молекулярных орбиталей в органической химии развивался от метода Хюккеля к методу валентных связей, ЛКАО-приближению и др. В органической химии широко используются представления о гибридизации атомных орбиталей. Этап проникновения орбитальных концепций в органическую химию открыла теория резонанса Л. Полинга (1931–1933) и далее работы Фукуи Кэнъити, Р. Б. Вудворда и Р. Хофмана о роли граничных орбиталей в определении направления химической реакции. Теория резонанса до сих пор широко используется в органической химии как метод описания строения одной молекулы набором канонических структур с одинаковым положением ядер, но с разным распределением электронов.
Общая характеристика реакций органических соединений
Реакции органических соединений имеют ряд специфических особенностей. В реакциях неорганических соединений обычно участвуют ионы; эти реакции протекают очень быстро, иногда мгновенно при нормальной температуре. В реакциях органических соединений обычно участвуют молекулы; при этом одни ковалентные связи разрываются, а другие – образуются. Такие реакции протекают медленнее ионных (иногда десятки часов), для их ускорения часто требуется повысить температуру или добавить катализатор. Наиболее часто в качестве катализаторов используют кислоты и основания. Обычно протекает не одна, а несколько реакций, так что выход нужного продукта очень часто составляет менее 50 %. В связи с этим в органической химии часто употребляют не химические уравнения, а схемы реакций без указания стехиометрических соотношений.
Реакции органических соединений могут протекать очень сложным образом и не обязательно соответствовать простейшей относительной записи (см. Сложные химические реакции). Как правило, простая стехиометрическая реакция на самом деле происходит в несколько последовательных стадий. В качестве промежуточных соединений (интермедиатов) в многостадийных химических реакциях могут возникать карбкатионы, карбанионы, свободные радикалы, карбены, катион-радикалы, анион-радикалы и другие нестабильные частицы, живущие доли секунды. Подробное описание всех изменений, которые происходят на молекулярном уровне в процессе превращения реагентов в продукты, называют механизмом химической реакции. Реакции органических соединений могут быть классифицированы в зависимости от способа разрыва и образования связей, метода возбуждения реакции, её молекулярности и др. Многие широко используемые реакции органических соединений называют по фамилиям химиков, их открывших или детально изучивших, – т. н. именные реакции (например, перегруппировка Бекмана, реакция Вюрца).  Кристофер Келк Инголд. 1956. Фото: Уолтер Стоунмен. Национальная портретная галерея, Лондон.Исследование влияния строения органических соединений на механизм их реакций изучает физическая органическая химия, основы которой заложили К. К. Инголд, Р. Робинсон и Л. П. Гаммет (1930-е гг.).
Кристофер Келк Инголд. 1956. Фото: Уолтер Стоунмен. Национальная портретная галерея, Лондон.Исследование влияния строения органических соединений на механизм их реакций изучает физическая органическая химия, основы которой заложили К. К. Инголд, Р. Робинсон и Л. П. Гаммет (1930-е гг.).
Взаимодействие между реагирующими молекулами с использованием представлений о молекулярных орбиталях описывается примерно так же, как взаимодействие между атомами при образовании молекул. Широкое распространение получил метод возмущений молекулярных орбиталей, на основе которого можно предсказать направление – региохимию и стереохимический результат (см. Стереоселективность, Стереоспецифичность) реакции, а также саму возможность её осуществления в данных условиях. Использование теории граничных орбиталей (Фукуи Кэнъити, 1952) послужило мощным стимулом к сближению экспериментальной органической химии с квантовой химией. Подлинным триумфом применения метода молекулярных орбиталей в органической химии явилось опубликование в 1965 г. правил Вудворда – Хофмана, на основе которых можно легко предсказать направление перициклических реакций и условия их проведения, необходимые для получения желаемого стереохимического результата.
Возникновение органических соединений
Большинство органических соединений в природе образуется в процессе фотосинтеза из диоксида углерода и воды под действием солнечного излучения, поглощаемого хлорофиллом в зелёных растениях. Однако органические соединения должны были существовать на Земле и до возникновения жизни, которая не могла появиться без них. Более 2 млрд лет назад, в добиологический период, первичная атмосфера Земли имела восстановительные свойства, т. к. в ней не было кислорода, а содержались в основном молекулярный водород, аммиак, пары́ воды, азот, диоксид углерода, благородные газы. Согласно одной из современных гипотез происхождения жизни, в атмосфере (под действием солнечного излучения, электрических разрядов, тепловой энергии земных недр и радиоактивного излучения) из химических элементов образовались простейшие неорганические (аммиак, циановодород, монооксид углерода, сероводород, гидроксиламин, гидразин и др.) и органические (углеводороды – прежде всего метан; альдегиды – формальдегид, уксусный альдегид; и др.) соединения. Высокореакционные первичные соединения послужили исходными веществами для синтеза биохимически важных органических молекул. Возможность абиогенного синтеза аминокислот (составных частей белков), азотистых оснований и сахаров (составных частей нуклеотидов, из которых состоят нуклеиновые кислоты) из простейших соединений доказана экспериментально (при действии различных источников энергии на газовые смеси, имитирующие первичную атмосферу Земли). Из этих составных частей образовывались всё более сложные органические вещества (в том числе молекулы или ансамбли молекул, способные к самовоспроизведению), пока, наконец, не появились условия для создания живой клетки.
