Кетоны
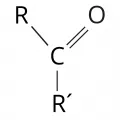
Кето́ны, органические соединения общей формулы R(R')C=O (R, R' – органические радикалы); относятся к карбонильным соединениям. Кетоны широко распространены в природе: кетонами являются некоторые природные душистые вещества, пигменты и красители, стероидные гормоны и др. Кетоны играют важную роль в метаболизме веществ в живых организмах.
Классификация
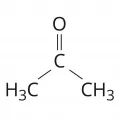
Простейший кетон алифатического ряда – ацетон, ароматического – бензофенон. В отличие от приведённых симметричных кетонов (одинаковые R и R') существуют кетоны, содержащие разные радикалы R и R', – несимметричные, или смешанные, например ацетофенон (жирноароматический кетон). У алициклических кетонов карбонильная группа C=O может входить в цикл (циклогексанон). Кетоны, содержащие 2 карбонильные группы в молекуле, подразделяют на 1,2-дикетоны (α-дикетоны), например диацетил, или бутандион, CH3–C(O)–C(O)–CH3; 1,3-дикетоны (β-дикетоны), например ацетилацетон, или 2,4-пентандион, CH3–C(O)–CH2–C(O)–CH3, и т. д. Среди циклических ненасыщенных дикетонов в особый класс выделяют хиноны. Названия кетонам дают в соответствии с правилами химической номенклатуры; для кетонов простого строения часто применяют рационально-функциональную номенклатуру, например метилэтилкетон (2-бутанон). Некоторые кетоны имеют тривиальные названия, в частности пинаколин (3,3-диметил-2-бутанон).
Физико-химические свойства
Низшие алифатические кетоны – бесцветные жидкости с характерным запахом, высшие – твёрдые вещества. Кетоны растворимы в органических растворителях, низшие – и в воде. Многие циклические кетоны обладают приятным запахом.
Карбонильная группа в кетонах менее реакционноспособна, чем в альдегидах, в частности более устойчива к окислению. Кетоны окисляются при нагревании сильными окислителями (например, KMnO4) с разрывом углеродной цепи по обе стороны от карбонильной группы до смеси карбоновых кислот. Циклические кетоны при взаимодействии с HNO3 или KMnO4 подвергаются окислительному расщеплению цикла: например, из циклогексанона образуется адипиновая кислота. Кетоны, содержащие α-атомы H, окисляются SeO2 до 1,2-дикетонов. Кетоны восстанавливаются до вторичных спиртов действием гидридов металлов (LiAlH4, NaBH4) или водорода (катализатор Ni, Pi); до углеводородов – действием гидразина в щелочной среде (реакция Кижнера – Вольфа) или амальгамы цинка в соляной кислоте (реакция Клемменсена).
Для кетонов характерны реакции присоединения нуклеофилов к карбонильной группе. Так, кетоны взаимодействуют с циановодородом, HCN, с образованием гидроксинитрилов, RR'C(OH)CN. Метилкетоны и циклические кетоны реагируют с бисульфитом натрия, образуя бисульфитные производные:
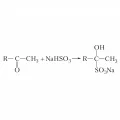 Реакция метилкетона с бисульфитом натрия.Гидролиз бисульфитных производных в кислой или щелочной среде используется для выделения и очистки кетонов. При взаимодействии кетонов с магнийорганическими соединениями и последующем гидролизе образуются третичные спирты (реакция Гриньяра): . Для кетонов характерны реакции замещения карбонильного атома кислорода: например, при взаимодействии с PCl5 атом кислорода в кетоне замещается на два атома хлора.
Реакция метилкетона с бисульфитом натрия.Гидролиз бисульфитных производных в кислой или щелочной среде используется для выделения и очистки кетонов. При взаимодействии кетонов с магнийорганическими соединениями и последующем гидролизе образуются третичные спирты (реакция Гриньяра): . Для кетонов характерны реакции замещения карбонильного атома кислорода: например, при взаимодействии с PCl5 атом кислорода в кетоне замещается на два атома хлора.
Кетоны вступают в многочисленные реакции конденсации: с гидразином образуют гидразоны, RR'C=N–NH2, и азины, RR'C=N–N=CRR'; с первичными аминами – шиффовы основания; с вторичными аминами – енамины; с гидроксиламином – кетоксимы, RR'C=NOH, – например, из диацетила образуется диметилглиоксим:
 Реакция диацетила с гидроксиламином.Кетоны, содержащие α-атомы H, являются CH-кислотами, для них характерна кето-енольная таутомерия. На енолизации основана способность таких кетонов реагировать как С- или О-нуклеофилы. Превращение в енолы особенно характерно для β-дикетонов:
Реакция диацетила с гидроксиламином.Кетоны, содержащие α-атомы H, являются CH-кислотами, для них характерна кето-енольная таутомерия. На енолизации основана способность таких кетонов реагировать как С- или О-нуклеофилы. Превращение в енолы особенно характерно для β-дикетонов: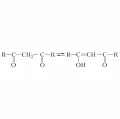 Кето-енольная таутомерия дикетона.Кетоны образуют продукты замещения α-атомов Н при галогенировании (действием Вr2, N-бромсукцинимида, SO2Cl2), аминометилировании (реакция Манниха). При алкилировании и ацилировании кетонов образуются либо продукты замещения α-атомов H, либо O-производные енолов. Большое значение в органическом синтезе имеют альдольная и крoтоновая конденсации. Кетоны вступают также в реакцию конденсации (подобной альдольной) с содержащими активную метиленовую группу веществами X–CH2–Y (X и Y – сильные электроноакцепторные группы) в присутствии оснований (реакция Кнёвенагеля).
Кето-енольная таутомерия дикетона.Кетоны образуют продукты замещения α-атомов Н при галогенировании (действием Вr2, N-бромсукцинимида, SO2Cl2), аминометилировании (реакция Манниха). При алкилировании и ацилировании кетонов образуются либо продукты замещения α-атомов H, либо O-производные енолов. Большое значение в органическом синтезе имеют альдольная и крoтоновая конденсации. Кетоны вступают также в реакцию конденсации (подобной альдольной) с содержащими активную метиленовую группу веществами X–CH2–Y (X и Y – сильные электроноакцепторные группы) в присутствии оснований (реакция Кнёвенагеля).
Получение
Кетоны получают окислением (в том числе по реакции Оппенауэра) или каталитическим дегидрированием вторичных спиртов: ; декарбоксилированием карбоновых кислот и их солей (катализаторы ThO2, BaO); гидролизом геминальных дизамещённых галогенпроизводных углеводородов, например: , и др. Ароматические и жирноароматические кетоны получают при действии на ароматические углеводороды хлорангидридов кислот в присутствии AlCl3 (реакция Фриделя – Крафтса), например: . Некоторые кетоны получают каталитическим окислением углеводородов кислородом воздуха – в частности, из этилбензола получают ацетофенон, из циклогексана – циклогексанон.
Применение
Кетоны применяют в качестве растворителей лаков, красок, смол, смазочных масел, как экстрагенты и стабилизаторы, душистые вещества в парфюмерии, ароматизаторы в пищевой промышленности, используют в производстве пестицидов, лекарственных препаратов, полимеров и др.