Изомерия
Изомери́я (от изо… и греч. μέρος – доля, часть), явление, заключающееся в существовании химических соединений, одинаковых по составу, с одинаковой молекулярной массой, но различающихся по структуре. Такие соединения называются изомерами. Изомеры могут превращаться друг в друга в результате реакций изомеризации. Структурные различия обусловливают различное взаимное влияние атомов в молекулах и предопределяют разные физические и химические свойства изомеров. Изомерия чрезвычайно распространена в органической химии и является одной из основных причин разнообразия и многочисленности органических соединений. В неорганической химии изомерия встречается в основном для комплексных соединений.
Историческая справка
 Уно Троили. Портрет Йёнса Якоба Берцелиуса. 1843. По картине Улофа Юхана Сёдермарка.
Национальный музей Швеции, Стокгольм.Термин «изомерия» ввёл Й. Я. Берцелиус в 1830 г., завершая полемику между Ю. фон Либихом и Ф. Вёлером по вопросу существования двух резко отличающихся по свойствам веществ, имеющих один и тот же состав AgCNO, – цианата и фульмината серебра, и опираясь на результаты исследований винной и виноградной кислот. Сущность изомерии была объяснена позднее на основе теории химического строения.
Уно Троили. Портрет Йёнса Якоба Берцелиуса. 1843. По картине Улофа Юхана Сёдермарка.
Национальный музей Швеции, Стокгольм.Термин «изомерия» ввёл Й. Я. Берцелиус в 1830 г., завершая полемику между Ю. фон Либихом и Ф. Вёлером по вопросу существования двух резко отличающихся по свойствам веществ, имеющих один и тот же состав AgCNO, – цианата и фульмината серебра, и опираясь на результаты исследований винной и виноградной кислот. Сущность изомерии была объяснена позднее на основе теории химического строения.
Виды изомерии
Выделяют 2 основных вида изомерии: структурную и пространственную (стереоизомерию). Структурные изомеры различаются порядком связей атомов в молекуле, т. е. химическим строением. Стереоизомеры (пространственные изомеры) при одинаковом порядке связей атомов в молекуле различаются взаимным расположением атомов в пространстве.
Структурная изомерия
Структурная изомерия подразделяется на изомерию углеродного скелета (скелетную изомерию), изомерию положения (позиционную изомерию), метамерию и другие виды.
Изомерия углеродного скелета
Изомерия углеродного скелета обусловлена различным порядком связей углеродных атомов, образующих скелет молекулы. Для конкретизации структурных особенностей изомеров скелетная изомерия подразделяется на изомерию углеродной цепи, изомерию цикла и изомерию боковой цепи. Например, изомерия углеродной цепи характерна для алканов начиная с четвёртого члена гомологического ряда C4H10, который имеет 2 структурных изомера: н-бутан CH3−CH2−CH2−CH3 и изобутан (2-метилпропан) CH3−CH(CH3)−CH3. Пятый член ряда алканов C5H12 имеет 3 изомера: CH3−CH2−CH2−CH2−CH3 – н-пентан, CH3−CH(CH3)−CH2−CH3 – изопентан (2-метилбутан) и неопентан (2,2-диметилпропан) CH3−(CH3)2−CH3. С удлинением цепи число возможных изомеров быстро возрастает. Так, для алканов состава C10H22 возможно существование 75 структурных изомеров, для C13H28 – 802 изомеров, для C20H42 – более 366 тыс. изомеров.
Для алициклических соединений характерны изомерия цикла и изомерия боковой цепи. Например, среди скелетных изомеров (формулы I–IV) метилциклопентан (I), циклогексан (II) и пропилциклопропан (III) являются циклическими изомерами, а пропилциклопропан (III) и изопропилциклопропан (IV) – изомерами боковой цепи.
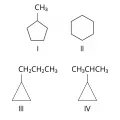 Скелетные изомеры.Различия в свойствах скелетных изомеров проявляются в разнице их температур кипения (изомеры с нормальной углеродной цепью кипят при более высокой температуре, чем изомеры с разветвлённой цепью), плотности и др. н-Алканы, например, в отличие от разветвлённых изомеров, обладают меньшей детонационной стойкостью, образуют комплексы с мочевиной (клатраты).
Скелетные изомеры.Различия в свойствах скелетных изомеров проявляются в разнице их температур кипения (изомеры с нормальной углеродной цепью кипят при более высокой температуре, чем изомеры с разветвлённой цепью), плотности и др. н-Алканы, например, в отличие от разветвлённых изомеров, обладают меньшей детонационной стойкостью, образуют комплексы с мочевиной (клатраты).
Изомерия положения
Изомерия положения обусловлена различным положением функциональных групп, заместителей или кратных связей. Например, изомерами положения являются 1-пропанол CH3−CH2−CH2OH и 2-пропанол CH3−CH(OH)−CH3, 1-бутен CH2=CH−CH2−CH3 и 2-бутен CH3−CH=CH−CH3.
Изменение положения функциональной группы может приводить к изменению класса соединения. Например, изомеры положения ацетон CH3−C(O)−CH3 и пропаналь CH3−CH2−CHO относятся соответственно к кетонам и альдегидам. Структурные изомеры с разными функциональными группами сильно различаются по химическим свойствам.
Часто различия в изомерах определяют несколько структурных признаков. Например, метилизопропилкетон (3-метил-2-бутанон) CH3−C(O)−CH(CH3)2 и валериановый альдегид (пентаналь) CH3−CH2−CH2−CH2−CHO отличаются друг от друга как структурой углеродного скелета, так и положением функциональной группы.
Метаметрия
Метамерия обусловлена различным положением гетероатома (O, N, S) в цепи. Например, метамерами являются метилпропиловый эфир CH3−O−CH2−CH2−CH3 и диэтиловый эфир CH3−CH2−O−CH2−CH3, диэтиламин CH3−CH2−NH−CH2−CH3 и метилпропиламин CH3−NH−CH2−CH2−CH3.
Таутомерия
Особым видом структурной изомерии является таутомерия (равновесная динамическая изомерия). В этом случае изомеры, различающиеся функциональными группами, легко переходят друг в друга до достижения равновесия, при котором вещество одновременно содержит молекулы таутомеров в определённом соотношении.
Пространственная изомерия
Пространственная изомерия подразделяется на геометрическую (цис-транс-, син-анти- и E-Z-изомерию) и оптическую.
Геометрическая изомерия
Геометрическая изомерия характерна для соединений, содержащих двойные связи или неароматические циклы, являющиеся структурно жёсткими фрагментами молекул. У цис-изомеров 2 заместителя расположены по одну сторону плоскости двойной связи или цикла, у транс-изомеров – по разные стороны. Например, геометрическими изомерами являются цис-2-бутен (формула V) и транс-2-бутен (VI), цис-1,2-дихлорциклопропан (VII) и транс-1,2-дихлорциклопропан (VIII).
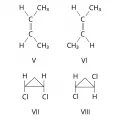 Геометрические изомеры (цис-транс-изомеры).Характерными различиями между цис- и транс-изомерами являются более низкая температура плавления цис-изомеров, значительно лучшая растворимость в воде и явно выраженный дипольный момент. транс-Изомеры обычно более стабильны (например, малеиновая и фумаровая кислоты).
Геометрические изомеры (цис-транс-изомеры).Характерными различиями между цис- и транс-изомерами являются более низкая температура плавления цис-изомеров, значительно лучшая растворимость в воде и явно выраженный дипольный момент. транс-Изомеры обычно более стабильны (например, малеиновая и фумаровая кислоты).
Геометрическую изомерию, наблюдаемую для соединений с двойными связями C=N (оксимы) и N=N (азосоединения, азоксисоединения), часто называют син-анти-изомерией. Например, геометрическими изомерами являются анти-бензальдоксим (формула IX) и син-бензальдоксим (X); син-азобензол (XI) и анти-азобензол (XII).
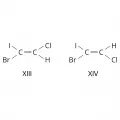
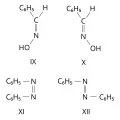 Геометрическая изомерия (син-анти-изомеры).В общем случае используется E,Z-номенклатура. У Z-изомеров старшие заместители (имеющие больший атомный номер) расположены по одну сторону двойной связи или цикла, у E-изомеров – по разные стороны. Например, геометрическими изомерами являются Z-1-бром-1-иод-2-хлорэтилен (формула XIII) и E-1-бром-1-иод-2-хлорэтилен (XIV).
Геометрическая изомерия (син-анти-изомеры).В общем случае используется E,Z-номенклатура. У Z-изомеров старшие заместители (имеющие больший атомный номер) расположены по одну сторону двойной связи или цикла, у E-изомеров – по разные стороны. Например, геометрическими изомерами являются Z-1-бром-1-иод-2-хлорэтилен (формула XIII) и E-1-бром-1-иод-2-хлорэтилен (XIV).
 Геометрическая изомерия (E-Z-изомеры).
Геометрическая изомерия (E-Z-изомеры).
Оптическая изомерия
 Луи Пастер. Фото: Надар.Оптическая изомерия характерна для соединений, молекулы которых имеют элементы хиральности, например асимметрический (хиральный) атом углерода, связанный с четырьмя разными заместителями. Впервые обнаружена Л. Пастером в 1848 г. на примере винных кислот и объяснена Я. Х. Вант-Гоффом и Ж. А. Ле Белем в 1874 г. на основе представлений о тетраэдрической конфигурации углеродных атомов в насыщенных соединениях.
Луи Пастер. Фото: Надар.Оптическая изомерия характерна для соединений, молекулы которых имеют элементы хиральности, например асимметрический (хиральный) атом углерода, связанный с четырьмя разными заместителями. Впервые обнаружена Л. Пастером в 1848 г. на примере винных кислот и объяснена Я. Х. Вант-Гоффом и Ж. А. Ле Белем в 1874 г. на основе представлений о тетраэдрической конфигурации углеродных атомов в насыщенных соединениях.
Молекулы, содержащие асимметрический атом углерода, могут быть представлены в виде двух оптических изомеров, которые не могут быть совмещены в пространстве (т. е. относятся друг к другу как предмет к своему зеркальному изображению). Такие зеркальные изомеры, отличающиеся лишь противоположным расположением одних и тех же заместителей у хирального центра, называются энантиомерами. Например, энантиомеры молочной кислоты (XV и XVI) можно представить в трёхмерном изображении или в виде формул Фишера.
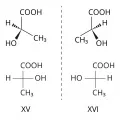 Энантиомеры молочной кислоты в трёхмерном изображении и в виде формул Фишера.Энантиомеры имеют различную биологическую активность; для них характерна также оптическая активность – способность воздействовать на плоскополяризованный свет (вращать плоскость поляризации). Энантиомеры вращают плоскость поляризации на один и тот же угол, но в противоположном направлении, поэтому их называют оптическими антиподами.
Энантиомеры молочной кислоты в трёхмерном изображении и в виде формул Фишера.Энантиомеры имеют различную биологическую активность; для них характерна также оптическая активность – способность воздействовать на плоскополяризованный свет (вращать плоскость поляризации). Энантиомеры вращают плоскость поляризации на один и тот же угол, но в противоположном направлении, поэтому их называют оптическими антиподами.
Длительное время конфигурацию энантиомеров определяли относительно конфигурации известного стандарта, которым служили энантиомеры глицеринового альдегида (D,L-стерические ряды). Более универсальной является R,S-номенклатура (предложена Р. С. Каном, К. К. Инголдом и В. Прелогом), устанавливающая абсолютную конфигурацию пространственных изомеров. В соответствии с правилами R,S-номенклатуры энантиомеры молочной кислоты (XV, XVI) являются соответственно (R)-молочной и (S)-молочной кислотами. Правил перевода D,L-номенклатуры в R,S-систему не существует, т. к. в этих номенклатурах используются разные принципы. Не установлено также связи между абсолютной конфигурацией и параметрами оптического вращения.
Процесс взаимопревращения энантиомеров называется рацемизацией. Смесь равных количеств оптических антиподов – рацемическая смесь, или рацемат, – не обладает оптической активностью. Стереоизомерии уделяется большое внимание при изучении природных соединений и синтезе биологически активных веществ. Веществам природного происхождения, содержащим элементы хиральности, присуща определённая стереоконфигурация, а также оптическая активность. При формировании хирального центра в условиях химического синтеза (за исключением асимметрического синтеза) образуется рацемат; для выделения энантиомеров требуется применение сложных методов разделения рацемата на оптически активные компоненты.
Диастереомерия
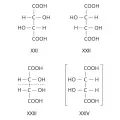
Для соединений, имеющих n хиральных центров в молекуле, количество возможных стереоизомеров составляет 2n. Однако при n⩾2 существуют стереоизомеры, которые отличаются друг от друга частью имеющихся в них элементов хиральности. Такие стереоизомеры, не являющиеся энантиомерами, называют диастереомерами. Например, для хлоряблочной кислоты, имеющей 2 асимметрических атома углерода, существуют 4 стереоизомера (формулы XVII–XX), среди которых пáры XVII и XVIII, а также XIX и XX являются энантиомерами, остальные пáры (XVII и XIX, XVII и XX, XVIII и XIX, XVIII и XX) – диастереомерами.
 Стереоизомеры хлоряблочной кислоты.При появлении дополнительных элементов симметрии (плоскости, оси или центра симметрии) общее число стереоизомеров, а также количество оптически активных форм может уменьшаться. Например, винные кислоты имеют 3 стереоизомера, из них 2 оптически активные: D-винная кислота, или (2R,3R)-винная кислота (формула XXI), и L-винная кислота, или (2S,3S)-винная кислота (XXII), являющиеся энантиомерами. Их диастереомер – мезовинная кислота, или (2R,3S)-винная кислота (формула XXIII, или идентичная конфигурация XXIV), вследствие наличия плоскости симметрии (обозначена пунктиром) оптически недеятельна – является т. н. внутримолекулярным рацематом.
Стереоизомеры хлоряблочной кислоты.При появлении дополнительных элементов симметрии (плоскости, оси или центра симметрии) общее число стереоизомеров, а также количество оптически активных форм может уменьшаться. Например, винные кислоты имеют 3 стереоизомера, из них 2 оптически активные: D-винная кислота, или (2R,3R)-винная кислота (формула XXI), и L-винная кислота, или (2S,3S)-винная кислота (XXII), являющиеся энантиомерами. Их диастереомер – мезовинная кислота, или (2R,3S)-винная кислота (формула XXIII, или идентичная конфигурация XXIV), вследствие наличия плоскости симметрии (обозначена пунктиром) оптически недеятельна – является т. н. внутримолекулярным рацематом.
 Стереоизомеры винной кислоты.
Стереоизомеры винной кислоты.
Поворотная изомерия
В результате внутреннего вращения молекул возникают конформационные изомеры, или конформеры, различающиеся степенью поворота фрагментов молекулы относительно одной или нескольких простых связей. В некоторых случаях можно выделить отдельные конформеры, иногда называемые также поворотными изомерами. Для изучения образования, различия в свойствах и реакционной способности конформеров используется конформационный анализ.
