Нитросоединения
Нитросоедине́ния (C-нитросоединения), органические соединения, содержащие нитрогруппу NO2, непосредственно связанную с атомом углерода. Изомерны эфирам азотистой кислоты (органическим нитритам). Соединения с нитрогруппой при атоме азота и кислорода выделяют в отдельные классы (соответственно нитрамины и органические нитраты).
Классификация
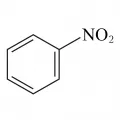
По числу нитрогрупп различают моно-, ди- и полинитросоединения; по положению – алифатические (нитроалканы и нитроалкены), ароматические (например, нитробензол, нитротолуолы, нитронафталины), жирноароматические (например, нитростирол C6H5CH=CHNO2) и смешанные (например, п-нитрофенилнитрометан O2NC6H4CH2NO2) нитросоединения. Ароматические нитросоединения относятся к третичным, остальные нитросоединения могут быть первичными, вторичными и третичными. Нитросоединения, имеющие в α-положении атом водорода, могут существовать в двух таутомерных формах.
 Таутомерия нитросоединений.Кислотная O-форма нитросоединений называется аци-формой или нитроновой кислотой. Многие превращения алифатических нитросоединений проходят с предварительной изомеризацией в нитроновые кислоты или с образованием мезомерного аниона. В растворах равновесие обычно практически полностью сдвинуто в сторону С-формы. Нитроновые кислоты в свободном виде неустойчивы, известны их производные (соли, эфиры и т. д.).
Таутомерия нитросоединений.Кислотная O-форма нитросоединений называется аци-формой или нитроновой кислотой. Многие превращения алифатических нитросоединений проходят с предварительной изомеризацией в нитроновые кислоты или с образованием мезомерного аниона. В растворах равновесие обычно практически полностью сдвинуто в сторону С-формы. Нитроновые кислоты в свободном виде неустойчивы, известны их производные (соли, эфиры и т. д.).
Физико-химические свойства
Простейшие алифатические нитросоединения – бесцветные жидкости; ароматические нитросоединения – бесцветные или светло-жёлтые высококипящие жидкости или низкоплавкие твёрдые вещества, обладающие характерным запахом (например, запах горького миндаля у нитробензола). Нитросоединения плохо растворяются в воде, хорошо – во многих органических растворителях. Алифатические нитросоединения хорошо растворяют различные органические соединения. При нагревании большинство нитросоединений разлагается (часто со взрывом).
Реакционная способность нитросоединений обусловливается как склонностью нитрогруппы к различным превращениям, так и влиянием её на другие реакционные центры в молекуле. Введение группы NO2 – сильнейшего электроноакцепторного заместителя, способного эффективно делокализовать отрицательный заряд, – резко увеличивает реакционную способность органических соединений по отношению к нуклеофильным реагентам и затрудняет реакции с электрофильными реагентами.
Алифатические нитросоединения восстанавливаются до гидроксиламинов и аминов, образуют соли при действии оснований. Для них характерны реакции по подвижному атому водорода, в том числе: присоединение в присутствии оснований к альдегидам и кетонам с образованием нитроспиртов (реакция Анри); присоединение к веществам, содержащим активированную двойную связь (реакция Михаэля); взаимодействие с алифатическими аминами и формальдегидом с образованием β-аминопроизводных (реакция Манниха); галогенирование, алкилирование, ацилирование. Анионы алифатических нитросоединений реагируют с электрофилами по двум направлениям: (M+ – катион металла, NH4; E – алкил, ацил, R3Si, RS и др.; Nu – галоген, SO3R и др.). Под действием сильных кислот происходит перегруппировка алифатических нитросоединений до гидроксамовых кислот, которые затем легко гидролизуются; метод используют в промышленноcти для синтеза уксусной кислоты СН3СООН и гидроксиламина из нитроэтана.
Ароматические нитросоединения восстанавливаются до аминов (важное свойство ароматических нитросоединений – их способность давать ряд продуктов восстановления: например, нитробензол последовательно восстанавливается до нитрозобензола, N-фенилгидроксиламина, азоксибензола, азобензола, гидразобензола, аминобензола – анилина); образуют аддукты с ароматическими углеводородами, аминами, щелочами и др.; нитрогруппа и атомы водорода цикла способны замещаться на другие функциональные группы. Реакции нуклеофильного замещения происходят легко, электрофильного – затруднённо; нуклеофил направляется в орто- и пара-положения, электрофил – в мета-положения к группе NO2. Активирующее влияние группы NO2 на нуклеофильное замещение широко используют в органическом синтезе.
Нитросоединения токсичны, могут оказывать наркотическое действие, вызывать поражение печени, почек, иногда глаз (катаракта), нарушать функции нервной системы, вызывать раздражение дыхательных путей, кожи и слизистых оболочек; ароматические нитросоединения – метгемоглобинемию.
Получение
В промышленности ароматические нитросоединения получают нитрованием ароматических соединений смесью серной и азотной кислот, а также окислением нитрозо-, диазо- и аминоаренов; алифатические нитросоединения – главным образом жидкофазным нитрованием алканов (реакция Коновалова) азотной кислотой или оксидами азота. Для получения низших нитроалканов используют также парофазное нитрование смеси этана, пропана и бутана, выделяемых из природного газа или полученных переработкой нефти.
Применение
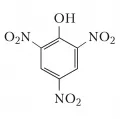
Полинитросоединения, особенно ароматические, применяют в качестве взрывчатых веществ (например, тринитрофенол, тринитротолуол).
Алифатические нитросоединения используют как растворители в лакокрасочной и полимерной промышленности; для очистки минеральных масел; депарафинизации нефти и др. Восстановлением ароматических нитросоединений получают ароматические амины – полупродукты в производстве различных красителей. Ряд нитросоединений находят применение в качестве инсектицидов, фунгицидов, гербицидов и антибиотиков. Некоторые ароматические нитросоединения – душистые вещества. Нитросоединения – реагенты в органическом синтезе, полупродукты в производстве полимеров, пластификаторов и модификаторов полимеров, ингибиторов коррозии, смачивающих, эмульгирующих и диспергирующих агентов.