Химия
Хи́мия, наука о веществах и законах превращений веществ; одна из отраслей естествознания. Важнейшими превращениями веществ, изучаемыми химией, являются химические реакции, обусловленные перестройкой электронных оболочек атомов, молекул, ионов, а также перегруппировкой атомных ядер в пространстве (состояние ядер при этом не меняется). Число химических объектов, воспроизводимых самой наукой, поистине безгранично. Это атомы, молекулы, супрамолекулы, материалы и т. д. В 2023 г. Химической реферативной службой (CAS) указано около 204 млн органических веществ, сплавов, координационных соединений, минералов, смесей, полимеров и солей, известных с начала 1800-х гг., и около 70 млн последовательностей белков и нуклеиновых кислот (CAS).
 Портрет Михаила Ломоносова. Середина 19 в. Копия с несохранившегося оригинала Георга Каспара Иосифа фон Преннера. 1755.В естествознании химия играет важнейшую роль, являясь ярко выраженной экспериментальной наукой. Её методы междисциплинарны и привлекают знания математики, физики, биологии, компьютерных и других наук. Химия создаёт фундамент для прогресса в молекулярной биологии и генной инженерии, в медицине, охране здоровья и окружающей среды, в материаловедении и создании новых источников и аккумуляторов энергии и т. д. На протяжении десятилетий искусственно созданный мир, окружающий человека, всё быстрее насыщается продуктами химического производства. Роль химии определена ещё в 1751 г. М. В. Ломоносовым: «Широко распростирает химия руки свои в дела человеческие... Куда ни посмотрим, куда ни оглянемся, везде обращаются пред очами нашими успехи её прилежания» (Ломоносов М. В. Слово о пользе химии, в публичном собрании Императорской Академии наук говоренное Михайлом Ломоносовым 6 (17) сентября 1751 г. // Ломоносов М. В. Полное собрание сочинений. Москва ; Ленинград, 1951. Т. 2. С. 362), и уже в 20 в. химия окончательно становится социально важной наукой, а 2011 и 2019 гг. были объявлены Организаций Объединённых Наций соответственно Международным годом химии и Международным годом Периодической таблицы химических элементов.
Портрет Михаила Ломоносова. Середина 19 в. Копия с несохранившегося оригинала Георга Каспара Иосифа фон Преннера. 1755.В естествознании химия играет важнейшую роль, являясь ярко выраженной экспериментальной наукой. Её методы междисциплинарны и привлекают знания математики, физики, биологии, компьютерных и других наук. Химия создаёт фундамент для прогресса в молекулярной биологии и генной инженерии, в медицине, охране здоровья и окружающей среды, в материаловедении и создании новых источников и аккумуляторов энергии и т. д. На протяжении десятилетий искусственно созданный мир, окружающий человека, всё быстрее насыщается продуктами химического производства. Роль химии определена ещё в 1751 г. М. В. Ломоносовым: «Широко распростирает химия руки свои в дела человеческие... Куда ни посмотрим, куда ни оглянемся, везде обращаются пред очами нашими успехи её прилежания» (Ломоносов М. В. Слово о пользе химии, в публичном собрании Императорской Академии наук говоренное Михайлом Ломоносовым 6 (17) сентября 1751 г. // Ломоносов М. В. Полное собрание сочинений. Москва ; Ленинград, 1951. Т. 2. С. 362), и уже в 20 в. химия окончательно становится социально важной наукой, а 2011 и 2019 гг. были объявлены Организаций Объединённых Наций соответственно Международным годом химии и Международным годом Периодической таблицы химических элементов.
Наиболее близкой к химии наукой является физика, но между этими родственными дисциплинами имеются принципиальные различия, как в изучаемых объектах, так и в методах работы и в профессиональном образовании. Все законы химии и все методы исследования веществ имеют физическую природу. Физика и химия взаимодействуют в квантовой теории, спектроскопии, термодинамике, в теории твёрдого тела, кристаллографии, нанотехнологиях и других областях. В то же время физика имеет дело с природой и очень больших масштабов (Вселенная), и очень малых масштабов (субатомные частицы). Химию же не интересуют такие формы материи, как кварки, барионы, лептоны или тёмная материя, которые не участвуют в трансформации одного вида вещества в другой и которые не наблюдаются в типичных земных условиях.
 Иоганн Керзебом. Портрет Роберта Бойля. 1689.
Институт истории науки, Филадельфия.Происхождение слова «химия» неясно. Название науки произошло от слова «алхимия» после выхода книги «Химик-скептик» (1661), в заголовке которой Р. Бойль опустил первый слог слова «алхимик», и вся область химических исследований стала называться «химия». В свою очередь, раннее слово «алхимия» (араб. الكيمياء, позднелат. alchemia), вероятно, заимствовано из греч. χυμεία, буквально – «искусство изготовления сплавов», которое произошло от древнего названия Египта – «чёрная земля». Слово «химия» впервые использовал александрийский алхимик Зосима из Панополиса в 4 в.
Иоганн Керзебом. Портрет Роберта Бойля. 1689.
Институт истории науки, Филадельфия.Происхождение слова «химия» неясно. Название науки произошло от слова «алхимия» после выхода книги «Химик-скептик» (1661), в заголовке которой Р. Бойль опустил первый слог слова «алхимик», и вся область химических исследований стала называться «химия». В свою очередь, раннее слово «алхимия» (араб. الكيمياء, позднелат. alchemia), вероятно, заимствовано из греч. χυμεία, буквально – «искусство изготовления сплавов», которое произошло от древнего названия Египта – «чёрная земля». Слово «химия» впервые использовал александрийский алхимик Зосима из Панополиса в 4 в.
Историческая справка
До нашей эры
Практическое использование химических процессов началось в эпоху палеолита, отмеченную освоением огня в Восточной Африке. Покорив огонь, человек постепенно перешёл к масштабному использованию новых технологий в конце неолита (в т. н. эпоху протометалла) и особенно в эпоху раннего металла – вначале химических процессов спекания и сплавления, а позже и к выплавке металлов.
В эпоху палеолита появляются новые материалы, актуальные по сей день и давно ставшие объектами химической науки и производства, – клей и керамика. Из керамики в Месопотамии были созданы древнейшие (поздний халколит) химические аппараты для дистилляции – аламбики.
Эпоха раннего металла – это главным образом освоение металлургических технологий: выплавки свинца, меди, бронзы, добычи олова. Ещё в неолите начинается изготовление шёлка, а в бронзовом веке – папируса. Важнейшими достижениями к концу 1-го тыс. до н. э. также стали производство железа, чугуна, стали, красителей, стекла, зеркал и бумаги. В связи с появлением медицины развивались фармацевтические технологии, в том числе получение лекарственных средств и ядов, как из минералов, так и из веществ растительного и животного происхождения, нередко использовались химические изменения биологических объектов (брожение и гниение).
В античной Элладе были разработаны поразительно продуманные технологии получения металлов. Например, серебро добывали из залежей сульфида свинца. Сначала руду обогащали особым способом, затем восстанавливали древесным углём, получая свинцово-серебряную смесь. Потом проводили купелирование, нагревая смесь в сосудах из глины и костной золы при продувании воздухом. При этом неблагородные металлы окислялись и полученные оксиды, растворяясь в оксиде свинца, всплывали как пена, после удаления которой получали чистое серебро.
 Средневековое оборудование для купелирования серебра. Иллюстрация из книги: Hoover C., Hoover H. De Re Metallica. New York, 1950.Наряду с накоплением опыта древними технологами-самоучками и наблюдениями природы в ходе её превращений, всё более актуальной становилась задача познания происходивших процессов превращения одних веществ в другие. Химия должна была обрести свои законы. В результате в Китае в 3 в. до н. э. появилась теория о мировых началах (стихиях, элементах), в качестве которых впервые выступили огонь, вода, дерево, земля и металл (впервые сформулировал китайский философ Цзоу Янь).
Средневековое оборудование для купелирования серебра. Иллюстрация из книги: Hoover C., Hoover H. De Re Metallica. New York, 1950.Наряду с накоплением опыта древними технологами-самоучками и наблюдениями природы в ходе её превращений, всё более актуальной становилась задача познания происходивших процессов превращения одних веществ в другие. Химия должна была обрести свои законы. В результате в Китае в 3 в. до н. э. появилась теория о мировых началах (стихиях, элементах), в качестве которых впервые выступили огонь, вода, дерево, земля и металл (впервые сформулировал китайский философ Цзоу Янь).
Эмпедокл в 5 в. до н. э. также считал, что всё состоит из четырёх первородных стихий – земли, воды, воздуха и огня, а противоборствующие силы – Любовь и Вражда – воздействуют на эти стихии, объединяя и разъединяя их в бесконечном количестве разнообразных форм. В 4 в. до н. э. каждой из четырёх стихий Платон поставил в соответствие правильный многогранник (полиэдр): огню – тетраэдр, воде – икосаэдр, земле – гексаэдр (куб), воздуху – октаэдр. Пятому многограннику – додекаэдру, по мнению Платона, соответствовал пятый элемент, который бог-творец использовал, чтобы создать небесные тела. Эти «корни мира» Платон назвал «словами», т. к. все вещи состоят из элементов, подобно тому как слова состоят из букв. Платон объединил учение о стихиях с уже существовавшей тогда атомистической концепцией строения вещества.
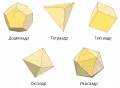 Многогранники Платона.Идеи «стихийного» мироустройства развил в 4 в. до н. э. ученик Платона Аристотель. В его системе каждый элемент представлял собой одно из состояний единой первоматерии, определённое сочетание основных качеств – тепла, холода, влажности и сухости (например, огонь – сочетание тепла и сухости, воздух – тепла и влажности). Аристотель добавил к четырём элементам пятый – эфир, заполняющий небесные сферы.
Многогранники Платона.Идеи «стихийного» мироустройства развил в 4 в. до н. э. ученик Платона Аристотель. В его системе каждый элемент представлял собой одно из состояний единой первоматерии, определённое сочетание основных качеств – тепла, холода, влажности и сухости (например, огонь – сочетание тепла и сухости, воздух – тепла и влажности). Аристотель добавил к четырём элементам пятый – эфир, заполняющий небесные сферы.
На пяти эпохах («эрах») строили своё мировосприятие ацтеки, увековечив их на знаменитом «Камне Солнца» (15 в.).
В конце 20 в. платоновы тела вдохновили химиков на сложнейший молекулярный дизайн каркасных молекул. В системе элементов-стихий можно усмотреть определённую логику, сопоставив их с известными агрегатными состояниями вещества – твёрдым (земля), жидким (вода), газообразным (воздух) и плазменным (огонь). Тем не менее эта теория, повсеместно просуществовавшая беспрецедентно долго (2000 лет), была научно абсолютно бесплодной, поскольку из неё не вытекали подтверждаемые гипотезы. И так было до тех пор, пока не появилась атомно-молекулярная теория, окончательно вытеснившая теорию загадочных стихий только в 19 в.
Идея атомарного строения материи была высказана как догадка финикийским философом Мохом Сидонским в конце 2-го тыс. до н. э. и легендарным мудрецом по прозвищу Канада, которому приписывается создание «Вайшешика-сутры» (около 1 в.) – основы индийской философской школы вайшешика.
Наиболее последовательно атомизм развивался в Древней Греции. Наблюдения над самыми разнообразными процессами позволили заметить, что любые изменения в природе происходят неравномерно, и при плавном изменении количественного признака происходит резкое изменение качества. Именно из таких философских построений и родилась идея об атомах как мельчайших частицах веществ. В атомистическом учении Левкиппа и его ученика Демокрита (5–4 вв. до н. э.), концептуально близком к физике Платона, всё совершающееся в мире обусловлено движением и соударением атомов, а появление и смерть вещей происходят в результате их объединения и разделения. Все вещи со временем погибают, но составляющие их атомы вечны. Демокрит, как и Платон, пытался примирить постулат об атомах с представлениями о четырёх стихиях, объясняя различие между последними величиной и формой атомов и уделяя особое внимание огню как состоящему из самых мелких шарообразных атомов. Атомы огня, как самые подвижные, Демокрит считал субстратом души. Эти идеи впоследствии развиты Эпикуром (4–3 вв. до н. э.), сформулировавшим постулат о вечном движении атомов и их спонтанных отклонениях от прямолинейных траекторий, и изложены Лукрецием в поэме «О природе вещей» (1 в. до н. э.). Левкипп различал атомы по форме, Демокрит – по форме и размерам, а Эпикур – по форме, размерам и весу. Представления о невидимых атомах настолько сильно расходились с общепринятыми взглядами на природу вещей, что на два последующих тысячелетия в качестве главных утвердились всё-таки идеи Платона и Аристотеля о вполне осязаемых и видимых стихиях.
Начало нашей эры
Античная алхимия возникла в эллинистическом Египте как причудливая смесь знаний и мистики. Это была невероятно долгая (без малого 16 веков) прелюдия к настоящей науке. Здесь было всё: начала и элементы, планеты и управляемые ими металлы, соединения и процессы под знаками зодиака, бесконечные попытки получить золото из праха земного и найти рецепт бессмертия. До сих пор алхимия – одна из интригующих, до конца не расшифрованных страниц истории. Свыше тысячи лет она привлекала внимание блестящих поэтов и художников, учёных и композиторов: У. Шекспира, Дж. Чосера, П. Брейгеля Старшего, И. В. Гёте и отражалась в их творчестве.
Западные алхимики полностью восприняли аристотелевскую картину мироустройства из четырёх стихий плюс пятая в виде эфира, «квинтэссенции» или «пятого элемента». Каждая из четырёх стихий характеризовалась индивидуальными качествами из разных пар: сухой – влажный и тёплый – холодный. Поэтому тёплый и влажный воздух можно было превратить в тёплый и сухой огонь при высушивании. Форму объекта определяло соотношение стихий, а превращение одной формы материи в другую достигалось изменением соотношения стихий при многократном нагревании, сжигании, выпаривании и перегонке. Восточная алхимия основывалась на стихиях воды, огня, дерева, металла и земли, в странах с китайским культурным влиянием – принципах инь и ян.
Исламская алхимия прославлена такими именами, как Джабир ибн Хайян, он же Гебер (арабский аптекарь; около 721 – около 815), Ибн Сина и Абу Бакр ар-Рази (арабский алхимик, около 865–925 или 934).
Первыми европейскими алхимиками считаются Альберт Великий и Р. Бэкон, увлекались алхимическими практиками И. Ньютон и Р. Бойль.
На счету алхимиков систематическое изучение простых веществ (что стало основой знаний о химических элементах), солей, щелочей, кислот и пороха. Изобретение пороха, а с ним и огнестрельного оружия называют революцией в военном деле (первая произошла, когда в войнах вместо камней и палок стали применять специально изготовленные мечи, луки, копья, доспехи и пр.).
Алхимики внесли значительный вклад в технологии получения сплавов, а развитый ими метод
 Агрикола Георг.перегонки положил начало производству спирта и парфюмерии. В 16–17 вв. алхимия связала свои цели с горным делом, металлургией, медициной и новыми материалами. Ключевые фигуры – «отец минералогии» Г. Агрикола и изобретатель майсенского фарфора немецкий алхимик И. Ф. Бёттгер. Но наиболее значительной в эпоху урбанизации и частых пандемий стала деятельность Парацельса – одного из основателей фармакологической отрасли химии (ятрохимии), который объяснял болезни нарушениями химических процессов в организме и искал специфические химические средства их лечения. Другой крупнейший ятрохимик – Франциск Сильвий, открывший в Лейденском университете первую химическую лабораторию для медицинских анализов. Во времена ятрохимии большинство химиков были аптекарями или врачами и развивали для своих профессиональных целей методы химического анализа, очистки и разделения веществ.
Агрикола Георг.перегонки положил начало производству спирта и парфюмерии. В 16–17 вв. алхимия связала свои цели с горным делом, металлургией, медициной и новыми материалами. Ключевые фигуры – «отец минералогии» Г. Агрикола и изобретатель майсенского фарфора немецкий алхимик И. Ф. Бёттгер. Но наиболее значительной в эпоху урбанизации и частых пандемий стала деятельность Парацельса – одного из основателей фармакологической отрасли химии (ятрохимии), который объяснял болезни нарушениями химических процессов в организме и искал специфические химические средства их лечения. Другой крупнейший ятрохимик – Франциск Сильвий, открывший в Лейденском университете первую химическую лабораторию для медицинских анализов. Во времена ятрохимии большинство химиков были аптекарями или врачами и развивали для своих профессиональных целей методы химического анализа, очистки и разделения веществ.
Все силы алхимии были брошены на получение «философского камня», о котором впервые рассказал, по преданиям, Гермес Трисмегист (см. Герметизм). Истории универсального катализатора и лекарства (а именно это и есть главные свойства «философского камня») нет конца: она тянется уже более тысячи лет. По многочисленным легендам, наиболее успешным алхимиком в трансмутации – превращении обычных металлов в золото – был парижский писарь Никола Фламель (1330–1418).
16–18 вв.
В 16–17 вв., несмотря на абсолютное главенство алхимии, базирующейся на идее о стихиях, Дж. Бруно и Г. Галилей возрождают античную атомистическую теорию. В книге П. Гассенди «О жизни и нравах Эпикура» (Gassendi P. De vita et moribus Epicuri libri octo. Lyons, 1647) впервые использовано слово «молекула» (новолат. molecula, уменьшительное от лат. moles – масса). Так же, как и Демокрит, Гассенди
 Жан-Шарль Франсуа. Портрет Пьера Гассенди. 1760–1767. Британский музей, Лондон.представляет материю состоящей из множества атомов, отделённых друг от друга пустотой. Число атомов и их форм конечно и постоянно, но число форм меньше числа атомов. Вслед за Демокритом Гассенди не признаёт за атомами запаха и вкуса, различая их по форме, весу и стремлению к движению. Это направление мысли поддержал Р. Бойль, главный труд которого – книга «Химик-скептик» – основан на корпускулярной теории (атомистике). Бойль отрицал идею о том, что элементы мироздания можно установить умозрительно (отсюда название работы) и был убеждённым сторонником экспериментального подхода к определению химических элементов (именно Бойлю приписывают заслугу введения в химию термина «анализ»). Заметное место в возрождении и развитии атомно-молекулярного учения занял М. В. Ломоносов. В работе 1741 г. с примечательным названием «Элементы математической химии» (сохранилась рукопись на латыни; опубликована Меншуткин Б. Н. Труды М. В. Ломоносова по физике и химии. Москва ; Ленинград, 1936. С. 45–50) Ломоносов чётко различает атом и молекулу (элемент и корпускулу). Именно в этой работе Ломоносов заявляет о зависимости свойств материи от рода, числа и расположения элементов, составляющих корпускулу.
Жан-Шарль Франсуа. Портрет Пьера Гассенди. 1760–1767. Британский музей, Лондон.представляет материю состоящей из множества атомов, отделённых друг от друга пустотой. Число атомов и их форм конечно и постоянно, но число форм меньше числа атомов. Вслед за Демокритом Гассенди не признаёт за атомами запаха и вкуса, различая их по форме, весу и стремлению к движению. Это направление мысли поддержал Р. Бойль, главный труд которого – книга «Химик-скептик» – основан на корпускулярной теории (атомистике). Бойль отрицал идею о том, что элементы мироздания можно установить умозрительно (отсюда название работы) и был убеждённым сторонником экспериментального подхода к определению химических элементов (именно Бойлю приписывают заслугу введения в химию термина «анализ»). Заметное место в возрождении и развитии атомно-молекулярного учения занял М. В. Ломоносов. В работе 1741 г. с примечательным названием «Элементы математической химии» (сохранилась рукопись на латыни; опубликована Меншуткин Б. Н. Труды М. В. Ломоносова по физике и химии. Москва ; Ленинград, 1936. С. 45–50) Ломоносов чётко различает атом и молекулу (элемент и корпускулу). Именно в этой работе Ломоносов заявляет о зависимости свойств материи от рода, числа и расположения элементов, составляющих корпускулу.
 Эллен Шарплс. Портрет Джозефа Пристли. Ок. 1797.
Национальная портретная галерея, Лондон.В 17–18 вв. развитию атомно-молекулярного учения способствовали химия газов (пневматическая химия), основанная на теории флогистона, и закон сохранения массы. Сформулированная И. Бехером и Г. Шталем теория флогистона стала, в сущности, первой единой теорией химии, позволившей обобщить множество реакций, что способствовало становлению химии как науки. Именно теория флогистона и похоронила таинственные стихии Аристотеля.
Эллен Шарплс. Портрет Джозефа Пристли. Ок. 1797.
Национальная портретная галерея, Лондон.В 17–18 вв. развитию атомно-молекулярного учения способствовали химия газов (пневматическая химия), основанная на теории флогистона, и закон сохранения массы. Сформулированная И. Бехером и Г. Шталем теория флогистона стала, в сущности, первой единой теорией химии, позволившей обобщить множество реакций, что способствовало становлению химии как науки. Именно теория флогистона и похоронила таинственные стихии Аристотеля.
История пневматической химии началась с исследований газов Я. Б. ван Гельмонтом и Дж. Пристли. В 1774 г. Пристли выделил газ, в котором ярко горели вещества, и назвал этот газ «дефлогистированным воздухом». Годом позже А. Л. де Лавуазье заявил, что воздух в экспериментах  Женевьева Броссар де Больё. Портрет Антуана Лорана де Лавуазье. 1784.
Национальный музей Версаля и Трианонов.Пристли не простое вещество, а смесь двух газов. Один из них – «дефлогистированный воздух» (кислород), который соединяется с горящими или ржавеющими предметами и необходим для дыхания. Работы Лавуазье («отца современной химии»), по сути, опровергли теорию флогистона, сменив её на кислородную теорию горения. Кроме того, удалось доказать, что вода (одно из аристотелевских начал) на самом деле устроена сложно и является продуктом соединения двух газов – водорода и кислорода. В «Начальном учебнике химии» (1789) известному с древнейших времен закону сохранения массы Лавуазье дал точную количественную формулировку. Все эти знания обеспечили рационализацию химии, внеся в неё количественные (измеряемые) характеристики как самые важные и, таким образом, превратив химию в настоящую науку с особой логичной номенклатурой (А. Лавуазье, А. Фуркруа, Л.-Б. Гитон де Морво, К.-Л. Бертолле). Научный переворот конца 18 в. часто называют «химической революцией».
Женевьева Броссар де Больё. Портрет Антуана Лорана де Лавуазье. 1784.
Национальный музей Версаля и Трианонов.Пристли не простое вещество, а смесь двух газов. Один из них – «дефлогистированный воздух» (кислород), который соединяется с горящими или ржавеющими предметами и необходим для дыхания. Работы Лавуазье («отца современной химии»), по сути, опровергли теорию флогистона, сменив её на кислородную теорию горения. Кроме того, удалось доказать, что вода (одно из аристотелевских начал) на самом деле устроена сложно и является продуктом соединения двух газов – водорода и кислорода. В «Начальном учебнике химии» (1789) известному с древнейших времен закону сохранения массы Лавуазье дал точную количественную формулировку. Все эти знания обеспечили рационализацию химии, внеся в неё количественные (измеряемые) характеристики как самые важные и, таким образом, превратив химию в настоящую науку с особой логичной номенклатурой (А. Лавуазье, А. Фуркруа, Л.-Б. Гитон де Морво, К.-Л. Бертолле). Научный переворот конца 18 в. часто называют «химической революцией».
Начало 19 в.
Начало 19 в. – время открытия фундаментальных законов химии. Одним из первых был открыт (1799–1808) закон постоянства состава (Ж. Пруст): каким бы способом ни было получено вещество, его химический состав и свойства остаются неизменными. При этом массы одного из элементов, приходящиеся на одну и ту же массу другого элемента, относятся как небольшие целые числа – закон кратных отношений (Дж. Дальтон, 1803).
Формулировка закона постоянства состава проходила на фоне дебатов с К.-Л. Бертолле, утверждавшим, что элементы могут соединяться друг с другом в любых отношениях. Время расставило всё на свои места: очевидна неуниверсальность закона постоянства состава и правота Бертолле только для некоторых веществ – бертоллидов (в отличие от дальтонидов). Закон постоянства состава и закон кратных отношений образовали фундамент стехиометрии; с этого времени в химию входят химические формулы веществ и химические уравнения реакций.
 Уно Троили. Портрет Йёнса Якоба Берцелиуса. 1843. По картине Улофа Юхана Сёдермарка.
Национальный музей Швеции, Стокгольм.В 1812–1819 Й. Берцелиус сформулировал дуалистическую теорию строения веществ, согласно которой все вещества состоят из двух начал электрической природы – положительного и отрицательного, что позволило ему создать классификацию химических элементов и их соединений и впервые подчеркнуть решающее значение кулоновского взаимодействия для химии (последнее окончательно доказано в квантовой теории). Введенное Й. Берцелиусом и Г. Дэви понятие об электроотрицательных и электроположительных элементах позволило качественно объяснить причину протекания ряда химических процессов и устойчивость бинарных соединений (количественное объяснение состоялось в 20–21 вв. и сформулировано в работах Л. Полинга, Р. С. Малликена, Р. Пирсона, Р. Парра, А. Р. Оганова и др.).
Уно Троили. Портрет Йёнса Якоба Берцелиуса. 1843. По картине Улофа Юхана Сёдермарка.
Национальный музей Швеции, Стокгольм.В 1812–1819 Й. Берцелиус сформулировал дуалистическую теорию строения веществ, согласно которой все вещества состоят из двух начал электрической природы – положительного и отрицательного, что позволило ему создать классификацию химических элементов и их соединений и впервые подчеркнуть решающее значение кулоновского взаимодействия для химии (последнее окончательно доказано в квантовой теории). Введенное Й. Берцелиусом и Г. Дэви понятие об электроотрицательных и электроположительных элементах позволило качественно объяснить причину протекания ряда химических процессов и устойчивость бинарных соединений (количественное объяснение состоялось в 20–21 вв. и сформулировано в работах Л. Полинга, Р. С. Малликена, Р. Пирсона, Р. Парра, А. Р. Оганова и др.).
В начале 19 в. были сформулированы законы эквивалентов (И. Рихтер, 1792–1802), объёмных отношений (Ж. Гей-Люссак, 1808) и равного числа молекул в одинаковых объёмах газов – закон Авогадро (А. Авогадро, 1811), а также гипотеза английского химика У. Праута о водороде как первичной материи, массу которого следует принять за единицу измерений (1816) (Prout).
В основу всех достижений химии этого периода легли представления Дж. Дальтона о реальности существования атомов, для которых он ввёл понятие атомного веса (массы) и впервые определил элемент как совокупность атомов одного вида. В работе «Новая система химической философии» Дальтон последовательно выстраивает атомную теорию, поставив каждому элементу в соответствие свой вид атомов и введя понятие об их относительной массе (химическая атомистика Дальтона).
 Вёлер Фридрих.В 19 в. интенсивно развиваются структурные теории. Сформировалась, во-первых, теория радикалов (Ф. Вёлер, Ж. Гей-Люссак, Ю. фон Либих, Ж.-Б. Дюма), согласно которой органические соединения состоят из радикалов, без изменения переходящих из одного соединения в другое. Во-вторых, теория типов Ш. Жерара (1851), согласно которой все вещества построены по нескольким типам и могут быть произведены путём замещения атомов водорода в типичном соединении другими атомами или радикалами. Эти работы в дальнейшем стали основой для представлений о трансферабельности групп атомов в химических процессах, обоснованных в 20 в. теорией возмущений.
Вёлер Фридрих.В 19 в. интенсивно развиваются структурные теории. Сформировалась, во-первых, теория радикалов (Ф. Вёлер, Ж. Гей-Люссак, Ю. фон Либих, Ж.-Б. Дюма), согласно которой органические соединения состоят из радикалов, без изменения переходящих из одного соединения в другое. Во-вторых, теория типов Ш. Жерара (1851), согласно которой все вещества построены по нескольким типам и могут быть произведены путём замещения атомов водорода в типичном соединении другими атомами или радикалами. Эти работы в дальнейшем стали основой для представлений о трансферабельности групп атомов в химических процессах, обоснованных в 20 в. теорией возмущений.
Большое значение для создания химической теории строения имело введение Э. Франклендом в 1852 г. понятия «соединительной силы», согласно которому каждый элемент образует соединения, связываясь с определённым числом эквивалентов других элементов. Химики начали изучать природу химических взаимодействий, введя понятия «валентность» (1868; немецкий химик К. Вихельхаус) и «химическая связь». Произошло деление химии на части – появились неорганическая химия, органическая химия и аналитическая химия. Были опубликованы работы Ф. А. Кекуле, который применил теорию валентности в органической химии и одновременно с Г. Кольбе впервые определил углерод как четырёхвалентный элемент.
 Портрет Александра Бутлерова. 2-я половина 19 в.Важными вехами стали теория химического строения органических соединений А. М. Бутлерова (1861), обнаружение способности атомов углерода образовывать цепи (Ф. А. Кекуле, А. Купер, 1858), стереохимическая теория Я. Х. Вант-Гоффа и Ж. А. Ле Беля (1874), доказательство циклического строения бензола (Ф. А. Кекуле, 1865), введение представления о кратных связях (Э. Эрленмейер, 1862) и о взаимном влиянии несвязанных атомов (В. В. Марковников, 1869), развитие универсальных методов органического синтеза (российский химик Е. Е. Вагнер, Ш. Фридель, Дж. Крафтс и др.) и неорганической стереохимии (в том числе создание координационной теории строения комплексных соединений А. Вернера, 1893).
Портрет Александра Бутлерова. 2-я половина 19 в.Важными вехами стали теория химического строения органических соединений А. М. Бутлерова (1861), обнаружение способности атомов углерода образовывать цепи (Ф. А. Кекуле, А. Купер, 1858), стереохимическая теория Я. Х. Вант-Гоффа и Ж. А. Ле Беля (1874), доказательство циклического строения бензола (Ф. А. Кекуле, 1865), введение представления о кратных связях (Э. Эрленмейер, 1862) и о взаимном влиянии несвязанных атомов (В. В. Марковников, 1869), развитие универсальных методов органического синтеза (российский химик Е. Е. Вагнер, Ш. Фридель, Дж. Крафтс и др.) и неорганической стереохимии (в том числе создание координационной теории строения комплексных соединений А. Вернера, 1893).
 Владимир Марковников.В 19 в. показана несостоятельность химической гипотезы, сформулированной Й. Берцелиусом, полагавшим, что в живых организмах существует непознаваемая наукой (нематериальная, сверхъестественная) сила, управляющая всеми явлениями жизни и, разумеется, превращениями органических веществ, – теория витализма. В 1828 г. Ф. Вёлер, синтезируя цианат аммония из минеральных веществ (цианата свинца, аммиака и воды), случайно получил органическое вещество – мочевину. Окончательно же витализм опровергли работы М.-Э. Шеврёля о составе сложных эфиров и М. Бертло, посвящённые синтезу аналогов природных жиров из жирных кислот и глицерина и получению этанола гидратацией этилена в присутствии серной кислоты (до этого этанол получали только брожением сахаристых веществ).
Владимир Марковников.В 19 в. показана несостоятельность химической гипотезы, сформулированной Й. Берцелиусом, полагавшим, что в живых организмах существует непознаваемая наукой (нематериальная, сверхъестественная) сила, управляющая всеми явлениями жизни и, разумеется, превращениями органических веществ, – теория витализма. В 1828 г. Ф. Вёлер, синтезируя цианат аммония из минеральных веществ (цианата свинца, аммиака и воды), случайно получил органическое вещество – мочевину. Окончательно же витализм опровергли работы М.-Э. Шеврёля о составе сложных эфиров и М. Бертло, посвящённые синтезу аналогов природных жиров из жирных кислот и глицерина и получению этанола гидратацией этилена в присутствии серной кислоты (до этого этанол получали только брожением сахаристых веществ).
19 в. отмечен открытием новых химических соединений, востребованных промышленными революциями и сыгравших выдающуюся роль в развитии цивилизации. Это в первую очередь бензол (М. Фарадей, 1825), нитробензол (Э. Митчерлих, 1833), стеарин (М.-Э. Шеврёль, Ж. Гей-Люссак, 1825), анилин (немецкий химик О. Унфердорбен, 1826; немецкий химик Ф. Ф. Рунге, 1834; российский химик Ю. Ф. Фрицше, 1841; Н. Н. Зинин, 1841; А. В. фон Гофман, 1843) и нитроглицерин (итальянский химик А. Собреро, 1847).
Важнейшим событием стало официальное принятие атомно-молекулярного учения на Международном химическом конгрессе в Карлсруэ (1860), однако только полвека спустя, когда наступила эра «квантовой революции», это учение превратилось в общетеоретический фундамент и физики, и химии.
Вторая половина 19 в.
 Портрет Дмитрия Менделеева. Середина 20 в.2-я половина 19 в. – время наивысшей активности Д. И. Менделеева, оставившего глубокий след в науке (в химии, физике, геологии, педагогике, экономике) и технике (в технологии, метрологии, нефтехимии, приборостроении). Событием века, да и вообще величайшим открытием в химии, стал периодический закон, открытый Менделеевым в 1869 г. Именно с этого момента структурная химия приобретает невиданную предсказательную силу, а термин «относительный» (хорошо известные относительные молекулярная, атомная или молярная массы, относительные характеристики элементов в группах или периодах, отношения в реакционных сериях, изолобальные и иные аналогии и т. д.) становится в химии одним из ключевых.
Портрет Дмитрия Менделеева. Середина 20 в.2-я половина 19 в. – время наивысшей активности Д. И. Менделеева, оставившего глубокий след в науке (в химии, физике, геологии, педагогике, экономике) и технике (в технологии, метрологии, нефтехимии, приборостроении). Событием века, да и вообще величайшим открытием в химии, стал периодический закон, открытый Менделеевым в 1869 г. Именно с этого момента структурная химия приобретает невиданную предсказательную силу, а термин «относительный» (хорошо известные относительные молекулярная, атомная или молярная массы, относительные характеристики элементов в группах или периодах, отношения в реакционных сериях, изолобальные и иные аналогии и т. д.) становится в химии одним из ключевых.
 Длинная форма периодической системы химических элементов (в соответствии с данными ИЮПАК на 2016).На протяжении всего 19 в. открывались всё новые и новые химические элементы, причём три из них – галлий, скандий и германий – были предсказаны в 1870 г. Менделеевым как «экаалюминий», «экабор» и «экасилиций» и открыты другими учёными соответственно в 1875, 1879 и 1886 гг. Предложенная в 1869 г. Менделеевым периодическая система химических элементов (таблица Менделеева, включающая по состоянию на 2023 118 элементов при общем числе атомов в наблюдаемой Вселенной ~1080) стала, по образному выражению А. Р. Оганова, «той самой шахматной доской, на которой разыгрываются все без исключения химические процессы, химические шахматные партии» (Открытая лекция «Химические свойства элементов как ключ к пониманию их поведения» // Rutube). Периодический закон стал основой для множества открытий, а новые элементы в таблице Менделеева появляются и в наши дни, в том числе и в России.
Длинная форма периодической системы химических элементов (в соответствии с данными ИЮПАК на 2016).На протяжении всего 19 в. открывались всё новые и новые химические элементы, причём три из них – галлий, скандий и германий – были предсказаны в 1870 г. Менделеевым как «экаалюминий», «экабор» и «экасилиций» и открыты другими учёными соответственно в 1875, 1879 и 1886 гг. Предложенная в 1869 г. Менделеевым периодическая система химических элементов (таблица Менделеева, включающая по состоянию на 2023 118 элементов при общем числе атомов в наблюдаемой Вселенной ~1080) стала, по образному выражению А. Р. Оганова, «той самой шахматной доской, на которой разыгрываются все без исключения химические процессы, химические шахматные партии» (Открытая лекция «Химические свойства элементов как ключ к пониманию их поведения» // Rutube). Периодический закон стал основой для множества открытий, а новые элементы в таблице Менделеева появляются и в наши дни, в том числе и в России.
В 19 в. в химии начинают изучаться экспериментально и теоретически катализ (Й. Берцелиус), химическая кинетика (К. М. Гульдберг и П. Вааге), термохимия (Г. И. Гесс, М. Бертло, российский химик В. Ф. Лугинин), химическая термодинамика (Дж. Гиббс, Я. Х. Вант-Гофф, В. Нернст), коллоидная химия (М. Фарадей, Т. Грэм, Дж. Гиббс), фотохимия (T. фон Гротгус, американский учёный Дж. Дрепер), электрохимия (М. Фарадей, С. Аррениус, В. Оствальд, В. Нернст, 1888), агрохимия и биохимия (Ю. Либих).
На рубеже 19–20 вв.
На рубеже 19–20 вв. и в начале 20 в. в физике были совершены открытия, которые привели к революции во взглядах на структуру материи. Открыто рентгеновское излучение (В. К. Рентген), благородные газы (У. Рамзай), радиоактивность химических элементов и их соединений (А. Беккерель, П. Кюри и М. Склодовская-Кюри). Особенно важно для химии открытие электрона в 1897 г. (Дж. Дж. Томсон): электрон впоследствии начинает широко использоваться в особом графическом языке, объясняющем и предсказывающем структуру вещества и механизмы реакций (В. Коссель, Г. Льюис и К. К. Инголд). Этот графический язык – электронные формулы молекул – широко распространён и ныне.
Фундаментальные открытия в физике привели к созданию квантовой механики. Уже в конце 1920-х гг. на основе квантовой механики начинает развиваться квантовая химия (В. Гайтлер, Ф. Лондон, Д. Хартри, Дж. Слэтер, Э. Хюккель, Р. Малликен, Л. Полинг и др.). Пионерами квантовой химии в СССР стали В. А. Фок, Я. К. Сыркин и М. Е. Дяткина. К сожалению, в 1951 г. непонимание этой науки спровоцировало надуманную полемику вокруг теории резонанса (мезомерии) Полинга – Инголда.
Квантовая теория обосновала периодический закон и строение атомов, наполнила ключевые понятия химии (валентность, химическая связь, ароматичность, структура, реакционная способность и пр.) физическим содержанием.
Вторая половина 20 в.
Во 2-й половине 20 в. квантовая механика стала фундаментом для спектральных методов исследования и нанотехнологий, в том числе для сборки молекул и наночастиц из отдельных атомов. По сути, именно квантовая теория окончательно превратила химию в фундаментальную науку, т. к. главные объекты изучения – атомы и молекулы – являются квантовыми объектами, а их превращения (реакции) – квантовыми событиями. В этой связи примечательна тематика Сольвеевских конгрессов по химии, проводимых международными Сольвеевскими институтами физики и химии: тематика конгрессов с 1-го (1922) до 25-го (2019) в основном связана с проблемами структурной (квантовой) химии. Квантовая механика позволила Фукуи Кэнъити сформулировать теорию граничных орбиталей (1952, см. также метод молекулярных орбиталей), фундаментальный принцип сохранения орбитальной симметрии Р. Вудворда и Р. Хофмана (1965, правила Вудворда – Хофмана) и разработать к концу 1960-х гг. эффективные компьютерные методы изучения структуры вещества (У. Кон и Дж. Попл, создавший комплекс программ квантово-химических расчетов Gaussian 70). Наконец, создание квантовой механики означало долгожданную и окончательную победу атомно-молекулярного учения, что дало основание Э. Шрёдингеру назвать изданную в 1948 г. статью «2400 лет квантовой теории» (Шрёдингер Э. Избранные труды по квантовой механике. Москва, 1976. С. 254–255).
В 20 в. к традиционным химическим методам изучения веществ и их превращений добавились методы смежных естественных наук. Симбиоз химических, физических, а нередко и биологических методов научного исследования становится в химии общепринятым. Наука приобрела невиданные ранее экспериментальные возможности в первую очередь благодаря развитию спектральных методов, хроматографии и микроскопии. Спектральные методы, основанные на взаимодействии электромагнитного поля с веществом, позволили разобраться в строении и реакционной способности любого вещества в различных диапазонах электромагнитной шкалы – от рентгеновских волн (рентгеновская спектроскопия) до радиоволн (ядерная спектроскопия).  Джеймс Уотсон и Фрэнсис Крик.Если в 19 в. между открытием бензола и установлением его структуры прошли десятилетия, то в 21 в. ЯМР-спектроскопия позволяет разобраться в структуре этого соединения за считаные минуты.
Джеймс Уотсон и Фрэнсис Крик.Если в 19 в. между открытием бензола и установлением его структуры прошли десятилетия, то в 21 в. ЯМР-спектроскопия позволяет разобраться в структуре этого соединения за считаные минуты.
Подлинным триумфом химии и биологии стала модель двойной спирали ДНК, эвристически построенная в 1953 г. Дж. Уотсоном и Ф. Криком на основании химических свойств и структуры нуклеотидов и рентгеноструктурных данных Р. Франклин. Установленные структуры ДНК и РНК полностью отвечали развитым ранее представлениям о макромолекулах.
Промышленная химия
Начавшаяся во второй половине 18 в. промышленная революция затронула в первую очередь машиностроение и текстильную индустрию. Производство текстиля стало остро нуждаться в соде, хлоре и серной кислоте, необходимых для получения отбеливателей и красителей, что повлекло за собой создание соответствующих химических предприятий.
В 19 в. индустрия серной кислоты стала высокорентабельной и научно обоснованной. В этот период кардинально поменялось не только сырьё (пирит вместо серы), но и технологические процессы на каждой из стадий (К. Винклер, 1875; немецкий инженер Р. Книч, 1890-е гг.). Промышленное производство соды началось с разработки и внедрения метода Н. Леблана в 1787–1791 гг., на смену которому пришёл более рентабельный и экологичный метод Э. Сольве (1861), ставший к началу 20 в. господствующим.
 Березниковский содовый завод.Создание империй, колониальные завоевания, бурное развитие коммуникаций инициировали в 19 в. промышленное производство новых взрывчатых веществ. Особенно следует отметить изобретение динамита (А. Нобель, 1867), сыгравшее выдающуюся роль не только в решении сугубо военных задач, но и в строительстве дорог, туннелей, каналов и пр.
Березниковский содовый завод.Создание империй, колониальные завоевания, бурное развитие коммуникаций инициировали в 19 в. промышленное производство новых взрывчатых веществ. Особенно следует отметить изобретение динамита (А. Нобель, 1867), сыгравшее выдающуюся роль не только в решении сугубо военных задач, но и в строительстве дорог, туннелей, каналов и пр.
Повышение уровня жизни в развитых странах, успехи медицины и гигиены способствовали росту народонаселения, что, в свою очередь, обострило проблему количества и качества пищи. Имевшиеся в распоряжении природные удобрения (фосфорные, азотные, калийные) не могли обеспечить устойчивость сельского хозяйства, поскольку вследствие развития химичес Установка контактного реактора высокого давления для синтеза аммиака.кой науки и других производств использовались по различным назначениям (например, природный ортофосфат кальция применялся не только в сельском хозяйстве, но и в металлургии, а калийные соли – в производстве стекла, пороха, красителей и др.). Агрохимия обосновала необходимость внесения в почву «патентованных» удобрений, созданных на химических предприятиях (первым стал завод по производству суперфосфата, построенный Дж. Лосом в 1843 в Великобритании). С 1870-х гг. производство удобрений достигло во всем мире промышленных масштабов. Внедрение в 1911–1916 гг. технологии синтеза аммиака (сырья для получения азотных удобрений) из атмосферного азота и водорода было удостоено Нобелевской премии [Ф. Габер (1918), К. Бош (1931)].
Установка контактного реактора высокого давления для синтеза аммиака.кой науки и других производств использовались по различным назначениям (например, природный ортофосфат кальция применялся не только в сельском хозяйстве, но и в металлургии, а калийные соли – в производстве стекла, пороха, красителей и др.). Агрохимия обосновала необходимость внесения в почву «патентованных» удобрений, созданных на химических предприятиях (первым стал завод по производству суперфосфата, построенный Дж. Лосом в 1843 в Великобритании). С 1870-х гг. производство удобрений достигло во всем мире промышленных масштабов. Внедрение в 1911–1916 гг. технологии синтеза аммиака (сырья для получения азотных удобрений) из атмосферного азота и водорода было удостоено Нобелевской премии [Ф. Габер (1918), К. Бош (1931)].
К важнейшим технологическим прорывам 1840–1900-х гг. относится создание индустрии синтетических красителей, обеспечившей независимость человека от природного сырья. Синтезы красителей на основе анилина [мовеин, У. Перкин-старший, 1856; фуксин, А. В. фон Гофман, 1858, и др.)], индоксила (индиго, А. Байер, 1883) и антрацена (ализарин, К. Гребе совместно с К. Либерманом и Г. Каро, 1869) стали по-настоящему инновационными, изменив профессиональную занятость людей в культивировании красильных растений.
 Пауль Эрлих в лаборатории. 1915.В свою очередь, химия красителей оказала мощное влияние на фармацевтическую промышленность. В 1878 г. П. Эрлих писал о том, что средства против бактерий надо искать среди красителей. Эта идея оказалась чрезвычайно плодотворной, приведя к созданию огромных химико-фармацевтических предприятий, производивших красители и лекарства одновременно (немецкие химические компании Bayer, BASF и др.), и идейно вдохновила химиков на создание новых лекарственных препаратов, таких как, например, производные анилина – арсаниловая кислота (французский химик-фармацевт А. Бешам), первый противотрипаносомозный препарат «Атоксил» (1861) и «Фенацетин», один из первых неопиоидных анальгетиков и антипиретиков (Bayer, 1887).
Пауль Эрлих в лаборатории. 1915.В свою очередь, химия красителей оказала мощное влияние на фармацевтическую промышленность. В 1878 г. П. Эрлих писал о том, что средства против бактерий надо искать среди красителей. Эта идея оказалась чрезвычайно плодотворной, приведя к созданию огромных химико-фармацевтических предприятий, производивших красители и лекарства одновременно (немецкие химические компании Bayer, BASF и др.), и идейно вдохновила химиков на создание новых лекарственных препаратов, таких как, например, производные анилина – арсаниловая кислота (французский химик-фармацевт А. Бешам), первый противотрипаносомозный препарат «Атоксил» (1861) и «Фенацетин», один из первых неопиоидных анальгетиков и антипиретиков (Bayer, 1887).
В 20 в. на основе арсаниловой кислоты А. Бертгейм в лаборатории П. Эрлиха в 1907 г. синтезировал «Сальварсан» (иначе – «препарат 606», арсфенамин), препарат, истинная структура которого не была известна вплоть до 2005). На базе ранней работы П. Гельмо (Австро-Венгрия, 1906) по химии красителей был получен первый сульфаниламидный препарат «Пронтозил» (Й. Кларер и Ф. Мицш в лаборатории Г. Домагка, 1932). Следует также отметить получение хлорохина (Х. Андерзаг в лаборатории Bayer, 1934) и хлорпромазина (П. Шарпантье, Франция, 1950), причём хлорпромазин, первый синтетический нейролептик, – модификация метиленового синего, синтезированного Г. Каро ещё в 1876 г. В этом же ряду и антисептик бриллиантовый зелёный («зелёнка»), синтезированный в Германии в качестве красителя волокон в 1879 г. Вклад химиков в борьбу с переносчиками тяжёлых заболеваний (малярии, жёлтой лихорадки и др.) переоценить невозможно. В ряду таких работ – исследования инсектицида ДДТ, произведённые химиком П. Мюллером (Швейцария, 1930–1940-е гг.).
Параллельно становлению производства красителей шло развитие текстильной индустрии. С конца 19 в. активно разрабатывались искусственные ткани из производных целлюлозы. Первые искусственные волокна произведены из нитроцеллюлозы (нитрошёлк, 1883), ксантогената целлюлозы (вискоза, 1905), ацетилцеллюлозы (ацетатный шёлк, 1921). Из вискозных волокон получили штапельную пряжу, из плёнки – целлофан (швейцарский химик Ж. Бранденбергер, 1908). Новый материал найлон (нейлон; полиамидные волокна, У. Карозерс, 1935) быстро вытеснил дорогой природный шёлк. В 1942 г. в Великобритании впервые получены полиэфирные волокна, наиболее важный представитель которых – полиэтилентерефталат; на основе полиэфиров в Японии в 1976 г. налажено производство микрофибры. В 1959 г. на основе полиуретана (немецкий химик О. Байер, 1937) получена лайкра, в 1946 г. на основе полиакрилонитрила (немецкие химики Х. Фикенчер, К. Хойкк, 1930) – нитрон. Поиск заменителей натуральной кожи привёл в начале 20 в. к появлению производства дерматина (DuPont), кирзы (М. М. Поморцев, Россия, 1903), поливинилхлорида (американский химик У. Симон, 1926) и других материалов.
Во 2-й половине 19 в. появились пластмассы, заменившие самые разные природные материалы – слоновую кость, янтарь, стекло, драгоценные камни и пр. Первым стал термопластик паркезин (английский металлург А. Паркс, 1856), позднее – целлулоид (американские изобретатели Дж. и И. Хайат, 1869).
В 1908 г. американский химик Л. Бакеланд наладил производство первого полностью синтетического пластика – бакелита [российский аналог – карболит (синтезирован в 1914)], важного для развития электро- и радиопромышленности.
 Реконструкция установки, с помощью которой был получен первый промышленный образец полиэтилена.В 1928–1933 гг. немецкий химик О. Рём изобрёл полиметилметакрилат, немедленно востребованный авиацией (современные органические заменители – прозрачные и лёгкие полистирол, поливинилхлорид, поликарбонат). В 1933 г. в Великобритании на заводе Imperial Chemical Industries в Виннингтоне впервые был получен полиэтилен высокого давления; в 1950-х гг. благодаря работам К. Циглера и Дж. Натты освоено промышленное производство полиэтилена низкого давления.
Реконструкция установки, с помощью которой был получен первый промышленный образец полиэтилена.В 1928–1933 гг. немецкий химик О. Рём изобрёл полиметилметакрилат, немедленно востребованный авиацией (современные органические заменители – прозрачные и лёгкие полистирол, поливинилхлорид, поликарбонат). В 1933 г. в Великобритании на заводе Imperial Chemical Industries в Виннингтоне впервые был получен полиэтилен высокого давления; в 1950-х гг. благодаря работам К. Циглера и Дж. Натты освоено промышленное производство полиэтилена низкого давления.
Вместе с тем производство пластических масс обнаружило проблему их сосуществования с живой природой. В среднем время жизни пластмасс насчитывает столетия, т. к. химические связи в них столь прочны, что делают пластмассы устойчивыми к большинству природных процессов деградации. Мусорные пятна по поверхности Мирового океана, свалки промышленных и бытовых отходов в крупных городах и т. д. актуализировали задачу утилизации пластических масс. Большие надежды возлагаются на производство биодеградируемых пластмасс (например, полилактатов), пластмасс с оксодобавками и др.
Химическая промышленность. 1900–1950-е гг.
1900–1950-е гг. стали временем бурного развития автомобилестроения. Для химии это означало насыщение потребности в синтетических каучуках для производства шин, как автомобильных, так и велосипедных. В 1888 г. ветеринарный врач шотландского происхождения Дж. Данлоп изобрёл технологию производства резиновых шин, основываясь на работах Ч. Гудьира (США) и Т. Хэнкока (Великобритания), открывших соответственно в 1839 и 1843 гг. вулканизацию каучука. Выдающийся вклад в производство синтетического каучука внесла русская химическая школа [В. Н. Ипатьев, И. Л. Кондаков, И. И. Остромысленский (известный также как создатель арсола – российской версии сальварсана), Б. В. Бызов, С. В. Лебедев]. Ещё в 1913 г. на петербургском заводе «Треугольник» Бызов внедрил технологию получения синтетического каучука из нефтяного сырья, а в 1926–1927 гг. Лебедевым разработан метод получения натрий-бутадиенового каучука из этанола (внедрён в СССР в 1932, с 1936 нашёл широкое применение в Германии под названием «Буна»). Бутадиен-стирольные каучуки или бутадиен-нитрильные каучуки широко используются не только в автомобилестроении, но и в электротехнике, медицинской технике и в ракетостроении (как полимерная основа при изготовлении твёрдого ракетного топлива).
 Первый советский нефтеперерабатывающий крекинг-завод в Баку. 1931.Совершенствование осветительных устройств, основанное на получении керосина канадским врачом и геологом А. Геснером в 1839 г. и на изобретении керосиновой лампы польским фармацевтом И. Лукасевичем в 1854 г., способствовало развитию нефтехимической промышленности. Широкое использование керосина и других продуктов нефтепереработки для освещения, в качестве растворителей, в медицине, в качестве смазочных материалов для машин и железнодорожного транспорта превратило добычу и переработку нефти в высокорентабельную индустрию. Развитие автомобилестроения и, позже, авиации стимулировало получение в постоянно возрастающих объёмах бензина – низкокипящей фракции при перегонке нефти. Однако наряду с этими процессами шёл также поиск методов получения синтетического жидкого топлива, и внедрённый в промышленность в 1930-х гг. синтез Фишера – Тропша стал лучшим.
Первый советский нефтеперерабатывающий крекинг-завод в Баку. 1931.Совершенствование осветительных устройств, основанное на получении керосина канадским врачом и геологом А. Геснером в 1839 г. и на изобретении керосиновой лампы польским фармацевтом И. Лукасевичем в 1854 г., способствовало развитию нефтехимической промышленности. Широкое использование керосина и других продуктов нефтепереработки для освещения, в качестве растворителей, в медицине, в качестве смазочных материалов для машин и железнодорожного транспорта превратило добычу и переработку нефти в высокорентабельную индустрию. Развитие автомобилестроения и, позже, авиации стимулировало получение в постоянно возрастающих объёмах бензина – низкокипящей фракции при перегонке нефти. Однако наряду с этими процессами шёл также поиск методов получения синтетического жидкого топлива, и внедрённый в промышленность в 1930-х гг. синтез Фишера – Тропша стал лучшим.
Выдающуюся роль в становлении российской химической промышленности сыграл В. Н. Ипатьев, исследовавший каталитические превращения высококипящих углеводородов и позже ставший одним из основателей американской нефтехимии. Помимо Ипатьева, важные исследования были выполнены Д. И. Менделеевым, А. Нобелем, Н. Д. Зелинским, В. В. Марковниковым, К. В. Харичковым и др.
Первым продуктом нефтехимического синтеза был изопропиловый спирт, синтезированный из газов при термическом крекинге нефти (США, 1918), а уже в 1950–1960-х гг. практически весь основной органический синтез перешёл с угольного сырья на нефтегазовое.
Химия и материаловедение
Химия всегда была основой материаловедения и главным творцом материалов, из которых создаётся необъятный мир вещей. Ещё в 19 в. без внедрения и совершенствования методов химии не состоялось бы производство стёкол с заданными свойствами, бумаги для быстро развивавшейся полиграфии, синтетических моющих средств, парфюмерии, продукции металлургии (чугуна, стали, алюминия) и пищевой промышленности (маргарина, сахара, консервов и их упаковки).
В 20 в. налажен базирующийся на достижениях химии выпуск антибиотиков, противовирусных средств, биоматериалов, различных продуктов тонкого органического синтеза. Уже тогда стало очевидно, что изъятие любого достижения химии из обыденной жизни способно изменить существование человека в худшую сторону. Именно это обстоятельство сделало химию важнейшим самоорганизующимся и безальтернативным двигателем научно-технического прогресса.
Нередко всё более совершенные вещества и материалы химии создают «про запас» и даже без плана их применения. В 1879–1881 гг. английские химики Ф. Джонс и Л. Тейлор впервые получили бороводороды, строение которых свыше полувека казалось непостижимым. Создание реактивной авиации потребовало высокоэнергетичных видов топлива. Оказалось, что именно бороводороды удовлетворяют большинству требований, что немедленно стимулировало теоретические и экспериментальные исследования в этой области (У. Липском и др.). Широкомасштабное изучение химии бора привело также к получению каркасных карборанов, сыгравших впоследствии видную роль в создании нейтронопоглощающих материалов для медицины.
В 1974 г. английским учёным Р. Пенроузом был предложен необычный способ замощения плоскости ромбами двух типов (тесселяция). Оказалось, что узор такого паркета имеет оси симметрии пятого порядка, что представлялось невероятным в мире кристаллов.
В 1982 г. Д. Шехтман экспериментально обнаружил паркет Пенроуза в структуре сплавов металлов и доказал, что такие необычные вещества (квазикристаллы) являются новой формой организации материи. Долгое время эти необычные материалы представляли исключительно академический интерес, и только в 21 в. им нашли разнообразные области применения. Ещё один пример – открытие фуллеренов (Г. Крото, Р. Смолли, Р. Кёрл, 1985); стабильность фуллерена С60 была предсказана в квантово-химических расчётах сотрудниками Института элементоорганических соединений АН СССР (Е. Г. Гальперн, Д. А. Бочваром и И. В. Станкевичем, 1973), нанотрубок (российские химики Л. В. Радушкевич и В. М. Лукьянович, 1952; японский физик Иидзима Сумио, 1991), графена (канадский физик Ф. Уоллес, 1947; свойства изучены российско-британскими физиками А. Геймом и К. С. Новосёловым, 2004) и других углеродных материалов, области технологического применения которых по сей день далеко не обозначены.
Горизонты химической науки
На протяжении столетий происходила постепенная дифференциация химии, которая к конце 20 в. насчитывала примерно 60 отраслей. Многие среди них, такие как физическая химия, радиационная химия, квантовая химия, кристаллохимия, фармацевтическая химия, химическая физика, ядерная химия, нанохимия и др., – пограничные. В 21 в. структура, задачи и цели химии начали в корне меняться. К важнейшему направлению её развития относится молекулярная электроника: создание молекулярных проводов и выпрямителей, молекулярных переключателей и трёхмерной оптической памяти – бистабильных молекулярных систем, материалов со сверхвысокоёмкой магнитной памятью, экономичных устройств отображения информации (дисплеев), молекулярного компьютера. Другие направления – создание наноматериалов, интеллектуальных материалов; когерентная и спиновая химия; развитие технологий, реализуемых в условиях мощных радиоактивных, ультразвуковых или электромагнитных воздействий, а также в суб- и сверхкритических состояниях; развитие теории химических реакций (фемтохимия, химия атомного разрешения, компьютерная химия); создание и совершенствование методов определения элементов и их соединений в окружающей среде (в том числе чувствительных химических сенсоров); создание активных материалов (пьезо- и сегнетоэлектрических на основе неклассических структур и др.); получение соединений с нелинейными оптическими свойствами; создание новых материалов для электрохимической энергетики; управление химическими технологиями на молекулярном уровне; химия жизни. Кроме того, огромное значение для человечества будут иметь приложения химии в области высокотемпературной сверхпроводимости, высокого давления, холодного ядерного синтеза, молекулярных магнетиков, сверхпроводящих полимеров, горения и взрыва (самораспространяющегося высокотемпературного синтеза, получения алмазов и т. п.).
Накопившиеся к концу 20 в. экологические проблемы, осознание химической общественностью ответственности перед будущими поколениями привели в 1990-х гг. к появлению «зелёной химии». Можно выделить главные направления её развития: использование каталитических методов синтеза и локальных источников энергии для активации молекул, а также биотехнологий для получения ряда промышленно важных веществ; использование в качестве растворителей ионных жидкостей и сверхкритических флюидных технологий, а также твердофазных реакций без растворителей; использование возобновляемых реагентов (биомассы, биоэтанола, биотоплива, лигнина).
Химия и общество
Развитие химии в течение последнего столетия придало особую остроту проблеме социальной ответственности учёного. Нередко, подчиняясь обстоятельствам, химики играли в истории негативную роль. Например, метод производства аммиака и азотной кислоты по Ф. Габеру стал основой для массового накопления взрывчатых веществ и боеприпасов. Их применение во время Первой мировой войны привело к огромным человеческим жертвам.
К позорным страницам истории следует отнести и применение пневматической химии в виде отравляющих веществ (газов) как Германией (Ф. Габер, О. Ган, В. Нернст), так и странами Антанты (В. Гриньяр, Г. Льюис), из-за чего Первую мировую войну нередко называют великой газовой войной или войной химиков. В этом же ряду использование отравляющих веществ, разработанных концерном I.G. Farbenindustrie AG для нацистских концлагерей.
Применение армией США дефолиантов во время войны во Вьетнаме, аварийный выброс метилизоцианата на заводе по производству пестицидов в Бхопале могут быть примерами событий, нанёсших колоссальный вред окружающей среде и получивших широкое освещение в СМИ. Они, а также отсутствие должного уровня химического образования у населения привели к появлению особых психических нарушений – хемофобий. Очевидно, что эта экстремальная реакция социума, как и её противоположность – слепая вера в безграничные возможности химии – являются результатами непродуманной и недальновидной политики по взаимодействию учёных и общества. Это значит, что уроки химии 20–21 вв. полезны для любых передовых научных дисциплин: учёный несёт моральную ответственность за результаты своей работы, нужно информировать других людей о потенциальных угрозах, а дружественные для человека и природы способы реализации тех или иных научных открытий необходимо искать, исследовать и широко популяризировать.
Образование и информация
В 21 в. химия пронизывает все сферы человеческого существования, делая науку о веществе всеобъемлющим, повсеместно востребованным знанием. Неслучайно химию изучают не только студенты всех естественно-научных и технических направлений, но и многие будущие гуманитарии.
Каждая из отраслей химии имеет собственный предмет исследований, свои методы эксперимента и даже свои учебные заведения и специализированные научные институты. Ведущими отечественными центрами высшего химического образования являются Москва, Казань, Ростов-на-Дону, Санкт-Петербург, Нижний Новгород, Новосибирск и др. Российская система школьного химического образования претерпела за последние десятилетия большие изменения, но неизменно включает олимпиады различного уровня, кружковые занятия, подготовку абитуриентов.
Беспрецедентно большое количество химической информации ещё в 19 в. потребовало издания детальных справочников. Ведущими стали справочник Л. Гмелина «Gmelin-Handbuch der anorganischen Chemie» (с 1817; с 1990 – «Gmelin Handbook of Inorganic and Organometallic Chemistry»; в 21 в. входит в базу данных Reaxys), реферативный журнал Pharmazeutisches Zentralblatt (1830–1969; переименован впоследствии в Chemisches Zentralblatt ), справочник Ф. Ф. Бейльштейна «Handbuch der organischen Chemie» (1881–1998; в 21 в. входит в базу данных Reaxys), «Chemical Abstracts» (1907–2010), реферативный журнал «Химия» (с 1953), справочники В. Фрезениуса «Handbuch der analytischen Chemie» (1940–1978), В. Тайльхаймера «Synthetische Methoden der Organischen Chemie» (1946–1950) и др. В 19 в. мировыми ведущими журналами по химии были «Журнал Русского физико-химического общества», Berichte der Deutschen chemischen Gesellschaft, Journal of the Chemical Society.
В 20 в. ситуация поменялась кардинально. А. Н. Несмеянов писал: «…в мире выходит около 10 тыс. названий периодических изданий, представляющих непосредственный интерес для химиков. В этих периодических изданиях ежегодно помещается не менее 200 тыс. публикаций по химии и химической технологии. Кроме того, в мире публикуется до 5 тыс. книг, свыше 30 тыс. патентов и около 20 тыс. научно-технических отчётов, полностью или частично относящихся к химии и химической технологии. <…> Если бы химик, свободно владеющий 30 языками (условие невероятное), начал с 1 января 1964 г. читать все выходящие в этом году публикации, представляющие для него профессиональный интерес, и читал бы их по 40 часов в неделю со скоростью 4 публикации в час, к 31 декабря 1964 г. он прочитал бы лишь с 1/20 часть этих публикаций» (Михайлов А. И. Основы информатики / А. И. Михайлов, А. И. Черный, Р. С. Гиляревский. Москва, 1968. С. 6). Это сказано в 1965 г., но с тех пор поток химической литературы вырос многократно. Для сбора, поиска, обработки, хранения и выдачи пользователям химической информации используют информационно-поисковые системы по химии.
В начале 21 в. получила развитие компьютерная (математическая) химия, использующая наряду с компьютерными методами теорию графов и комбинаторику. При этом молекулы моделируются графами, а химические реакции – операциями с графами (компьютерное моделирование в химии). К важнейшим задачам компьютерной химии относятся: поиск зависимостей типа «структура – свойство» (структура – свойства соотношения количественные); компьютерный синтез; распознавание химической структуры при работе с соответствующими базами данных и пр. Методы компьютерной химии нередко сочетают с методами квантовой химии, молекулярной механики, информатики (хемоинформатика), математической статистики и искусственного интеллекта (ИИ), главная технология которого – машинное обучение, а цель – большие данные (big data).
 Робот-химик.Экспансия ИИ позволила получить в химии и смежных с ней областях впечатляющие результаты. Колоссальное достижение ИИ в экспериментальной химии – автоматизация рутинных процессов. Роботы-химики могут синтезировать множество небольших молекул, точно взвешивать препараты и титровать растворы, строить гипотезы и проверять их, не подвергаясь профессиональному выгоранию. С помощью самообучающегося ИИ удаётся за кратчайшее время получать максимально эффективные катализаторы и надёжно предсказывать структуру веществ в любых (в том числе экстремальных) условиях. Так, ещё в 2006 г. квантово-химические расчёты (Structures and Potential Superconductivity in SiH4 at High Pressure: En Route to «Metallic Hydrogen» / Ji Feng, W. Grochala, T. Jaron [et al.] // Physical Review Letters. 2006. Vol. 96, № 1. P. 017006) возможных структур сверхпроводящего при высоких давлениях силана SiH4 проиграли ИИ, обнаружившему более устойчивые формы вещества (Pickard C. J. High-Pressure Phases of Silane / C. J. Pickard, R. J. Needs // Physical Review Letters. 2006. Vol. 97, № 4. P. 045504). В 21 в. ИИ помогает медицинской химии в поиске новых эффективных лекарственных средств (в том числе ферментов с новыми типами активности и терапевтических молекул для редких заболеваний), предсказании токсичности наноматериалов для систем их доставки и в изучении растворимости новых препаратов в различных средах. Также ИИ демонстрирует свою эффективность в работе химиков, занятых в парфюмерной индустрии, причём не только в автоматизации многих процессов, но даже (с 2019) в создании рецептур ароматов.
Робот-химик.Экспансия ИИ позволила получить в химии и смежных с ней областях впечатляющие результаты. Колоссальное достижение ИИ в экспериментальной химии – автоматизация рутинных процессов. Роботы-химики могут синтезировать множество небольших молекул, точно взвешивать препараты и титровать растворы, строить гипотезы и проверять их, не подвергаясь профессиональному выгоранию. С помощью самообучающегося ИИ удаётся за кратчайшее время получать максимально эффективные катализаторы и надёжно предсказывать структуру веществ в любых (в том числе экстремальных) условиях. Так, ещё в 2006 г. квантово-химические расчёты (Structures and Potential Superconductivity in SiH4 at High Pressure: En Route to «Metallic Hydrogen» / Ji Feng, W. Grochala, T. Jaron [et al.] // Physical Review Letters. 2006. Vol. 96, № 1. P. 017006) возможных структур сверхпроводящего при высоких давлениях силана SiH4 проиграли ИИ, обнаружившему более устойчивые формы вещества (Pickard C. J. High-Pressure Phases of Silane / C. J. Pickard, R. J. Needs // Physical Review Letters. 2006. Vol. 97, № 4. P. 045504). В 21 в. ИИ помогает медицинской химии в поиске новых эффективных лекарственных средств (в том числе ферментов с новыми типами активности и терапевтических молекул для редких заболеваний), предсказании токсичности наноматериалов для систем их доставки и в изучении растворимости новых препаратов в различных средах. Также ИИ демонстрирует свою эффективность в работе химиков, занятых в парфюмерной индустрии, причём не только в автоматизации многих процессов, но даже (с 2019) в создании рецептур ароматов.
Организации и учреждения
Химия представлена многочисленными авторитетными международными и национальными химическими обществами.  Логотип Международного союза теоретической и прикладной химии.Старейшие химические общества: Лондонское (1841), Парижское (1857, с 1906 Французское химическое общество), Немецкое (1867), Русское (1868; ныне Российское химическое общество имени Д. И. Менделеева), Американское (1876). В 1911 г. создана Международная ассоциация химических обществ, в 1919 г. – Международный союз теоретической и прикладной химии IUPAC (ИЮПАК), который занимается вопросами химической номенклатуры, терминологии, обозначений, адресов организаций, ресурсов и т. п.
Логотип Международного союза теоретической и прикладной химии.Старейшие химические общества: Лондонское (1841), Парижское (1857, с 1906 Французское химическое общество), Немецкое (1867), Русское (1868; ныне Российское химическое общество имени Д. И. Менделеева), Американское (1876). В 1911 г. создана Международная ассоциация химических обществ, в 1919 г. – Международный союз теоретической и прикладной химии IUPAC (ИЮПАК), который занимается вопросами химической номенклатуры, терминологии, обозначений, адресов организаций, ресурсов и т. п.
 Николай Семёнов. 1966.Другие ассоциации: European Association for Chemical and Molecular Sciences (EuChemS) – Федерация европейских химических обществ; The Federation of Asian Chemical Societies (FACS) – Федерация химических обществ Азии. В РФ функционирует Российский союз предприятий и организаций химического комплекса (Российский союз химиков, РСХ), объединяющий предприятия химического сектора, отраслевые научно-исследовательские, проектные и учебные институты, союзы и ассоциации химической направленности. Площадками для общения широкого круга специалистов традиционно являются выставки и конференции по химии и химической промышленности.
Николай Семёнов. 1966.Другие ассоциации: European Association for Chemical and Molecular Sciences (EuChemS) – Федерация европейских химических обществ; The Federation of Asian Chemical Societies (FACS) – Федерация химических обществ Азии. В РФ функционирует Российский союз предприятий и организаций химического комплекса (Российский союз химиков, РСХ), объединяющий предприятия химического сектора, отраслевые научно-исследовательские, проектные и учебные институты, союзы и ассоциации химической направленности. Площадками для общения широкого круга специалистов традиционно являются выставки и конференции по химии и химической промышленности.
В конце 19 в. А. Нобелем учреждена премия как высшая оценка достижений в науке, литературе и борьбе за мир. В 20 в. Нобелевская премия по химии вручалась гражданину СССР Н. Н. Семёнову (1956) и гражданам других стран, родившимся на территории Российской империи (В. Оствальд, 1909; М. Склодовская-Кюри, 1911; П. Каррер, 1937; А. Виртанен, 1945).  Большая золотая медаль имени М. В. Ломоносова.Престижны также медали Дэви, Румфорда, Копли Лондонского королевского общества, Лекторская премия Фарадея (Faraday Lectureship Prize, которой в 1889 был удостоен Д. И. Менделеев), премия Вольфа и другие награды. РАН присуждает именные золотые медали и премии (медали Д. И. Менделеева, Н. С. Курнакова, А. М. Бутлерова, Н. Н. Семёнова; премии В. Н. Ипатьева, Н. Д. Зелинского, Л. А. Чугаева, В. Г. Хлопина и др.). Химикам вручается и высшая награда РАН – Большая золотая медаль имени М. В. Ломоносова.
Большая золотая медаль имени М. В. Ломоносова.Престижны также медали Дэви, Румфорда, Копли Лондонского королевского общества, Лекторская премия Фарадея (Faraday Lectureship Prize, которой в 1889 был удостоен Д. И. Менделеев), премия Вольфа и другие награды. РАН присуждает именные золотые медали и премии (медали Д. И. Менделеева, Н. С. Курнакова, А. М. Бутлерова, Н. Н. Семёнова; премии В. Н. Ипатьева, Н. Д. Зелинского, Л. А. Чугаева, В. Г. Хлопина и др.). Химикам вручается и высшая награда РАН – Большая золотая медаль имени М. В. Ломоносова.

