Свободные радикалы
Свобо́дные радика́лы (радикалы), частицы (атомы, молекулы, фрагменты молекул), содержащие один или несколько неспаренных электронов на внешних атомных или молекулярных орбиталях. Примеры неорганических и органических радикалов – гидроксил HO• и этоксил C2H5O• (неспаренный электрон обозначают точкой). Частицы с двумя неспаренными электронами на атомных орбиталях разных атомов называют бирадикалами; например, (C6H5)2C•C6H4–C6H4C•(C6H5)2. Свободные радикалы электронейтральны. Отдача или принятие электрона нейтральной частицей, не имеющей неспаренных электронов, приводит к образованию ион-радикалов (катион-радикалов или анион-радикалов) – частиц, обладающих одновременно зарядом и неспаренным электроном; примеры – катион-радикал бензола C6H6•+, анион-радикал бензофенона (C6H5)2C•–O−.
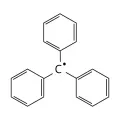
Термин «радикал», одно из наиболее эволюционировавших понятий в химии, предложил в 1782 г. Л. Б. Гитон де Морво. В рамках кислородной теории А. Лавуазье радикалом (от лат. radix, род. п. radicis – корень, основание) называли «кинетические начала» кислот (по Лавуазье, кислоты – соединения кислорода с радикалами). Постепенно понятие «радикал» уходило из неорганической химии и перемещалось преимущественно в органическую химию. Лавуазье предложил словосочетание «свободный радикал» для обозначения углеводородов вследствие их способности соединяться с кислородом. Ю. Либих и Ф. Вёлер обнаружили (1832), что группа C6H5CO (названная ими бензоилом) в реакциях «горькоминдального масла» (бензальдегида) остаётся неизменной и легко обнаруживается в бензойной кислоте, бензальдегиде, бензоилхлориде, бензамиде. Постепенно выявлялись ряды органических соединений, в которых неизменной составляющей был органический радикал (например, этил C2H5 – в этиловом спирте, этилхлориде, диэтиловом эфире и др.). Под радикалом стали понимать группировки, входящие в состав органических молекул в неизменённом виде (следует иметь в виду, что до настоящего времени название «радикал» используется в номенклатуре органических соединений для обозначения заместителей – углеводородных остатков, составляющих молекулу; например, боковая цепь в 3-метилпентане – метильный радикал). В 1839 г. Ж.-Б Дюма, действуя хлором на уксусную кислоту, получил моно-, ди- и трихлоруксусные кислоты, показав тем самым, что и неизменяющаяся составная часть способна к превращениям. Для доказательства существования радикалов предпринимались попытки выделить их в свободном состоянии. Эти эксперименты в течение длительного периода не были успешны. Так, в 1849 г. Г. Кольбе (электролизом солей карбоновых кислот) и Э. Франкленд (нагреванием алкилиодидов с цинком) получили не «свободные метил и этил», а их димеры: этан и бутан. Впервые истинный свободный радикал – трифенилметильный (C6H5)3C• – получен в 1900 г. М. Гомбергом при нагревании бензольного раствора трифенилметилхлорида с порошком серебра в инертной атмосфере. В 1929 г. Ф. Панет зафиксировал метильные радикалы и определил среднюю продолжительность их жизни (в токе водорода и при давлении 1–2 мм рт. ст. время жизни метильных радикалов CH3• примерно 0,0084 с).
Свободные радикалы условно можно разделить на две большие группы: высокоактивные (нестабильные, короткоживущие) и стабильные (долгоживущие). Стабильность свободных радикалов связана с возможностью делокализации (распределения) заряда неспаренного электрона по резонансным формам радикала и с возможностью экранирования реакционного центра с неспаренным электроном (пространственный фактор). Как правило, свободные радикалы обладают парамагнитными свойствами. Наиболее широко используемым аналитическим методом исследования свободных радикалов в конденсированной фазе и в растворе является спектроскопия электронного парамагнитного резонанса (ЭПР). Высокая чувствительность метода ЭПР позволяет также использовать свободные радикалы в качестве спиновых зондов и меток. Для изучения свойств высокоактивных свободных радикалов используют метод матричной изоляции, в котором активные радикалы стабилизируют («замораживают») в твёрдой фазе – т. н. инертных матрицах (обычно твёрдых благородных газах).
Генерирование свободных радикалов происходит при термическом, фотохимическом, радиационном воздействии на различные вещества и материалы, в результате электролиза, окислительно-восстановительных реакций и пр. Радикалы образуются из молекул в результате разрыва связи, при котором на каждом фрагменте остаётся по электрону (гомолитические реакции), а также из других радикалов либо в результате реакций между радикалом и молекулой. Реакционная способность свободных радикалов изменяется в широких пределах, но большинство из них – высокореакционноспособные частицы. Свободные радикалы легко вступают в дальнейшие реакции, в результате чего могут образовываться устойчивые продукты (реакции рекомбинации, диспропорционирования, окисления и восстановления) или другие реакционноспособные свободные радикалы (реакции замещения, присоединения, распад, перегруппировки). Свободные радикалы часто являются интермедиатами многостадийных химических реакций (например, цепных реакций).
Свободные радикалы играют большую роль во многих промышленных процессах: полимеризации, пиролиза, горения, взрыва, катализа и др. Свободные радикалы широко распространены в природе (обнаружены в земной атмосфере, в космосе). Свободные радикалы участвуют в биохимических процессах метаболизма (дыхание, фотосинтез и пр.). Исследование свободных радикалов позволяет выяснить, как протекает поражение клеток и какие защитные механизмы в них существуют. Так, согласно гипотезе Н. М. Эмануэля (1977), рост раковых клеток сопровождается изменением количества активных свободных радикалов почти на всех стадиях гликолиза и окисления. Стабильные свободные радикалы способны замедлять (ингибировать) цепные реакции, т. е. выступать в роли антиоксидантов. В свою очередь, короткоживущие активные радикалы проявляют высокую цитотоксичность, а следовательно, способны разрушать раковые клетки (трудность заключается в локальном генерировании таких «радикалов-киллеров» именно в злокачественной опухоли).