Атом
А́том [франц. atome, от лат. atomus, от греч. ἄτομος (οὐσία) – неделимая (сущность)], частица вещества, наименьшая часть химического элемента, являющаяся носителем его свойств. Атомы каждого элемента индивидуальны по строению и свойствам и обозначаются химическими символами элементов (например, атом водорода – Н, железа – Fe, ртути – Hg, урана – U и т. д.). Атомы могут существовать как в свободном состоянии, так и в связанном. Всё многообразие веществ обусловлено различными сочетаниями атомов между собой. Свойства газообразных, жидких и твёрдых веществ зависят от свойств составляющих их атомов. Все физические и химические свойства атома определяются его строением и подчиняются квантовым законам. Об истории развития учения об атоме см. в статье Атомная физика.
Общая характеристика строения атомов
Атом состоит из тяжёлого ядра, обладающего положительным электрическим зарядом, и окружающих его лёгких электронов с отрицательными электрическими зарядами, образующих электронные оболочки атома. Размеры атома определяются размерами его внешней электронной оболочки и велики по сравнению с размерами ядра атома. Характерные порядки диаметров, площадей поперечного сечения и объёмов атома и ядра составляют:
Электронные оболочки атома не имеют строго определённых границ, и значения размеров атома в большей или меньшей степени зависят от способов их определения.
Заряд ядра – основная характеристика атома, обусловливающая его принадлежность определённому элементу. Заряд ядра всегда является целым, кратным положительному элементарному электрическому заряду, равному по абсолютному значению заряду электрона . Заряд ядра равен , где – порядковый номер (атомный номер). для атома последовательных элементов в периодической системе химических элементов, т. е. для атомов . В нейтральном атоме ядро с зарядом удерживает электронов с общим зарядом . Атом может потерять или присоединить электронов и стать положительным или отрицательным ионом ( – кратность его ионизации). К атому определённого элемента часто относят и его ионы. При написании ионы отличают от нейтрального атома индексом и ; например, – нейтральный атом кислорода, – его положительные и отрицательные ионы. Совокупность нейтрального атома и ионов других элементов с тем же числом электронов образует изоэлектронный ряд, например ряд водородоподобных атомов .
Кратность заряда ядра атома элементарному заряду получила объяснение на основании представлений о строении ядра: равно числу протонов в ядре, заряд протона равен . Масса атома возрастает с увеличением . Масса ядра атома приближённо пропорциональна массовому числу – общему числу протонов и нейтронов в ядре. Масса электрона (0,91·10−27 г) значительно меньше (примерно в 1840 раз) массы протона или нейтрона (1,67·10−24 г), поэтому масса атома в основном определяется массой его ядра.
Атомы данного элемента могут отличаться массой ядра (число протонов постоянно, число нейтронов может меняться); такие разновидности атомов одного и того же элемента называются изотопами. Различие массы ядра почти не сказывается на строении электронных оболочек данного атома, зависящем от , и свойствах атома. Наибольшие отличия в свойствах (изотопные эффекты) получаются для изотопов водорода () из-за большой разницы в массах обычного лёгкого атома водорода (), дейтерия () и трития ().
Масса атома изменяется от 1,67·10−24 г (для основного изотопа атома водорода, ) до примерно 4·10−22 г (для атомов трансурановых элементов). Наиболее точные значения масс атомов могут быть определены методами масс-спектроскопии. Масса атома не равна в точности сумме массы ядра и масс электронов, а несколько меньше – на дефект массы , где – энергия образования атома из ядра и электронов (энергия связи), – скорость света. Эта поправка порядка массы электрона для тяжёлых атомов, а для лёгких пренебрежимо мала (порядка 10−4 ).
Энергия атома и её квантование
Благодаря малым размерам и большой массе атомное ядро можно приближённо считать точечным и покоящимся в центре масс атома (общий центр масс ядра и электронов находится вблизи ядра, а скорость движения ядра относительно центра масс атома мала по сравнению со скоростями движения электронов). Соответственно атом можно рассматривать как систему, в которой электронов с зарядами движутся вокруг неподвижного притягивающего центра. Движение электронов в атоме происходит в ограниченном объёме, т. е. является связанным. Полная внутренняя энергия атома равна сумме кинетических энергий всех электронов и потенциальной энергии – энергии притяжения их ядром и отталкивания друг от друга.
Согласно теории атома, предложенной в 1913 г. Нильсом Бором, в атоме водорода один электрон с зарядом движется вокруг неподвижного центра с зарядом . В соответствии с классической механикой кинетическая энергия такого электрона равна
где – скорость, – количество движения (импульс) электрона. Потенциальная энергия (сводящаяся к энергии кулоновского притяжения электрона ядром) равна
и зависит только от расстояния электрона от ядра. Графически функция изображается кривой, неограниченно убывающей при уменьшении , т. е. при приближении электрона к ядру. Значение при принято за нуль. При отрицательных значениях полной энергии движение электрона является связанным: оно ограничено в пространстве значениями . При положительных значениях полной энергии движение электрона является свободным – он может уйти на бесконечность с энергией , что соответствует ионизованному атому водорода . Таким образом, нейтральный атом водорода – система электростатически связанных ядра и электрона с энергией .
Полная внутренняя энергия атома – его основная характеристика как квантовой системы (см. Квантовая механика). Атом может длительно находиться лишь в состояниях с определённой энергией – стационарных (неизменных во времени) состояниях. Внутренняя энергия квантовой системы, состоящей из связанных микрочастиц (в том числе атомов), может принимать одно из дискретного (прерывного) ряда значений Каждому из этих «дозволенных» значений энергии соответствует одно или несколько стационарных квантовых состояний. Промежуточными значениями энергии (например, лежащими между и , и и т. д.) система обладать не может, о такой системе говорят, что её энергия квантована. Любое изменение связано с квантовым (скачкообразным) переходом системы из одного стационарного квантового состояния в другое (см. ниже).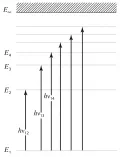 Рис. 1. Схема уровней энергии атома.
Рис. 1. Схема уровней энергии атома.
Возможные дискретные значения (3) энергии атома графически можно изобразить по аналогии с потенциальной энергией тела, поднятого на различные высоты (на различные уровни), в виде схемы уровней энергии, где каждому значению энергии соответствует прямая, проведённая на высоте (рис. 1). Самый нижний уровень , соответствующий наименьшей возможной энергии атома, называется основным, а все остальные () – возбуждёнными, т. к. для перехода на них (перехода в соответствующие стационарные возбуждённые состояния из основного) необходимо возбудить систему – сообщить ей извне энергию .
Квантование энергии атома является следствием волновых свойств электронов. Согласно принципу корпускулярно-волнового дуализма, движению микрочастицы массы со скоростью соответствует длина волны , где – постоянная Планка. Для электрона в атоме порядка 10−8 см, т. е. порядка линейных размеров атома, и учёт волновых свойств электрона в атоме является необходимым. Связанное движение электрона в атоме схоже со стоячей волной, и его следует рассматривать не как движение материальной точки по траектории, а как сложный волновой процесс. Для стоячей волны в ограниченном объёме возможны лишь определённые значения длины волны (и, следовательно, частоты колебаний ). Согласно квантовой механике, энергия атома связана с соотношением и поэтому может принимать лишь определённые значения. Свободное, не ограниченное в пространстве поступательное движение микрочастицы, например движение электрона, оторванного от атома (с энергией ), сходно с распространением бегущей волны в неограниченном объёме, для которой возможны любые значения (и ). Энергия такой свободной микрочастицы может принимать любые значения (не квантуется, имеет непрерывный энергетический спектр). Такая непрерывная последовательность соответствует ионизованному атому. Значение соответствует границе ионизации; разность называется энергией ионизации; для атома водорода она равна 13,6 эВ.
Распределение электронной плотности
Точное положение электрона в атоме в данный момент времени установить нельзя вследствие соотношения неопределённостей. Состояние электрона в атоме определяется его волновой функцией, определённым образом зависящей от его координат; квадрат модуля волновой функции характеризует плотность вероятности нахождения электрона в данной точке пространства. Волновая функция в явном виде является решением уравнения Шрёдингера.
Таким образом, состояние электрона в атоме можно характеризовать распределением в пространстве его электрического заряда с некоторой плотностью – распределением электронной плотности. Электроны как бы «размазаны» в пространстве и образуют «электронное облако». Такая модель правильнее характеризует электроны в атоме, чем модель точечного электрона, движущегося по строго определённым орбитам (в теории атома Бора). Вместе с тем каждой такой боровской орбите можно сопоставить конкретное распределение электронной плотности. Для основного уровня энергии электронная плотность концентрируется вблизи ядра; для возбуждённых уровней энергии она распределяется на всё бoльших средних расстояниях от ядра. В многоэлектронном атоме электроны группируются в оболочки, окружающие ядро на различных расстояниях и характеризующиеся определёнными распределениями электронной плотности. Прочность связи электронов с ядром во внешних оболочках меньше, чем во внутренних, и слабее всего электроны связаны в самой внешней оболочке, обладающей наибольшими размерами.
Учёт спина электрона и спина ядра
В теории атома весьма существен учёт спина электрона – его собственного (спинового) момента количества движения, с наглядной точки зрения соответствующего вращению электрона вокруг собственной оси (если электрон рассматривать как частицу малых размеров). Со спином электрона связан его собственный (спиновый) магнитный момент. Поэтому в атоме необходимо учитывать, наряду с электростатическими взаимодействиями, и магнитные взаимодействия, определяемые спиновым магнитным моментом и орбитальным магнитным моментом, связанным с движением электрона вокруг ядра; магнитные взаимодействия малы по сравнению с электростатическими. Наиболее существенно влияние спина в многоэлектронных атомах: от спина электронов зависит заполнение электронных оболочек атома определённым числом электронов.
Ядро в атоме также может обладать собственным механическим моментом – ядерным спином, с которым связан ядерный магнитный момент в сотни и тысячи раз меньший электронного. Существование спинов приводит к дополнительным, очень малым взаимодействиям ядра и электронов (см. ниже).
Квантовые состояния атома водорода
Важнейшую роль в квантовой теории атома играет теория простейшего одноэлектронного атома, состоящего из ядра с зарядом и электрона с зарядом , т. е. теория атома водорода и водородоподобных ионов , называемая обычно теорией атома водорода. Методами квантовой механики можно получить точную и полную характеристику состояний электрона в одноэлектронном атоме. Задача о многоэлектронных атомах решается лишь приближённо; при этом исходят из результатов решения задачи об одноэлектронном атоме.
Энергия одноэлектронного атома в нерелятивистском приближении (без учёта спина электрона) равна целое число определяет возможные дискретные значения энергии – уровни энергии – и называется главным квантовым числом, – постоянная Ридберга, равная 13,6 эВ. Уровни энергии атома сходятся (сгущаются) к границе ионизации , соответствующей . Для водородоподобных ионов изменяется (в раз) лишь масштаб значений энергий. Энергия ионизации водородоподобного атома (энергия связи электрона) равна (в электронвольтах)
что даёт для значения 13,6 эВ, 54,4 эВ, 122,4 эВ, ….
Основная формула (4) соответствует выражению для потенциальной энергии электрона в электрическом поле ядра с зарядом . Эта формула была впервые выведена Н. Бором путём рассмотрения движения электрона вокруг ядра по круговой орбите радиуса и является точным решением уравнения Шрёдингера для такой системы. Уровням энергии (4) соответствуют орбиты радиуса где постоянная см – радиус первой круговой орбиты атома водорода, соответствующей его основному уровню (этим боровским радиусом часто пользуются в качестве удобной единицы для измерений длин в атомной физике). Радиус орбит пропорционален квадрату главного квантового числа и обратно пропорционален ; для водородоподобных ионов масштаб линейных размеров уменьшается в раз по сравнению с атомом водорода. Релятивистское описание атома водорода с учётом спина электрона даётся уравнением Дирака.
Согласно квантовой механике, состояние атома водорода полностью определяется дискретными значениями четырёх физических величин: энергии ; орбитального момента (момента количества движения электрона относительно ядра); проекции орбитального момента на произвольно выбранное направление ; проекции спинового момента (собственного момента количества движения электрона ). Возможные значения этих физических величин, в свою очередь, определяются квантовыми числами соответственно. В приближении, когда энергия атома водорода описывается формулой (4), она определяется только главным квантовым числом , принимающим целочисленные значения . Уровню энергии с заданным соответствует несколько состояний, различающихся значениями орбитального (азимутального) квантового числа . Состояния с заданными значениями и принято обозначать как , где цифры указывают значение , а буквы (дальше по латинскому алфавиту) – соответственно значения . При заданных и число различных состояний равно – числу комбинаций значений магнитного орбитального квантового числа и магнитного спинового числа (первое принимает значений, второе – 2 значения). Общее число различных состояний с заданными и получается равным . Таким образом, каждому уровню энергии атома водорода соответствует (при ) различных стационарных квантовых состояний. Если уровню энергии соответствует лишь одно квантовое состояние, то его называют невырожденным, если два или более – вырожденным, а число таких состояний называется степенью или кратностью вырождения (для невырожденных уровней энергии ). Уровни энергии атома водорода являются вырожденными, а их степень вырождения .
 Рис. 2. Электронное облако одноэлектронного атома в различных состояниях.Для различных состояний атома водорода получается и разное распределение электронной плотности. Оно зависит от квантовых чисел , и . При этом электронная плотность для -cocтояний () отлична от нуля в центре, т. е. в месте нахождения ядра, и не зависит от направления (сферически симметрична), а для остальных состояний () она равна нулю в центре и зависит от направления. Распределение электронной плотности для состояний атома водорода с показано на рис. 2; размеры «электронного облака» растут в соответствии с формулой (6) пропорционально (масштаб на рис. 2 уменьшается при переходе от к и от к ).
Рис. 2. Электронное облако одноэлектронного атома в различных состояниях.Для различных состояний атома водорода получается и разное распределение электронной плотности. Оно зависит от квантовых чисел , и . При этом электронная плотность для -cocтояний () отлична от нуля в центре, т. е. в месте нахождения ядра, и не зависит от направления (сферически симметрична), а для остальных состояний () она равна нулю в центре и зависит от направления. Распределение электронной плотности для состояний атома водорода с показано на рис. 2; размеры «электронного облака» растут в соответствии с формулой (6) пропорционально (масштаб на рис. 2 уменьшается при переходе от к и от к ).
Квантовые состояния электрона в водородоподобных ионах характеризуются теми же четырьмя квантовыми числами , , и , что и в атоме водорода. Сохраняется и распределение электронной плотности, только она увеличивается в раз.
Действие на атом внешних полей
Атом как электрическая система во внешнем электрическом и магнитном полях приобретает дополнительную энергию. Электрическое поле поляризует атом – смещает электронные облака относительно ядра (см. Поляризуемость атомов, ионов и молекул), а магнитное поле ориентирует определённым образом магнитный момент атома, связанный с движением электрона вокруг ядра (с орбитальным моментом ) и его спином. Различным состояниям атома водорода с той же энергией во внешнем поле соответствуют разные значения дополнительной энергии , и вырожденный уровень энергии расщепляется на ряд подуровней. Как расщепление уровней энергии в электрическом поле – эффект Штарка, так и их расщепление в магнитном поле – эффект Зеемана – пропорциональны напряжённостям соответствующих полей.
К расщеплению уровней энергии приводят и малые магнитные взаимодействия внутри атома. Для атома водорода и водородоподобных ионов имеет место спин-орбитальное взаимодействие – взаимодействие спинового и орбитального моментов электрона; оно обусловливает т. н. тонкую структуру уровней энергии – расщепление возбуждённых уровней (при ) на подуровни. Для всех уровней энергии атома водорода наблюдается и сверхтонкая структура, обусловленная очень малыми магнитными взаимодействиями ядерного спина с электронными моментами.
Электронные оболочки многоэлектронных атомов
Теория атомов, содержащих 2 или более электронов, принципиально отличается от теории атома водорода, т. к. в таком атоме имеются взаимодействующие друг с другом одинаковые частицы – электроны. Взаимное отталкивание электронов в многоэлектронном атоме существенно уменьшает прочность их связи с ядром. Например, энергия отрыва единственного электрона в ионе гелия () равна 54,4 эВ, в нейтральном же атоме гелия в результате отталкивания электронов энергия отрыва одного из них уменьшается до 24,6 эВ. Для внешних электронов более тяжёлых атомов уменьшение прочности их связи из-за отталкивания внутренними электронами ещё более значительно. Важную роль в многоэлектронных атомах играют свойства электронов как одинаковых микрочастиц (см. Принцип тождественности), обладающих спином , для которых справедлив принцип Паули. Согласно этому принципу, в системе электронов не может быть более одного электрона в каждом квантовом состоянии, что приводит к образованию электронных оболочек атомов, заполняющихся строго определёнными числами электронов.
Учитывая неразличимость взаимодействующих между собой электронов, имеет смысл говорить только о квантовых состояниях атома в целом. Однако приближённо можно рассматривать квантовые состояния отдельных электронов и характеризовать каждый из них совокупностью квантовых чисел , , и , аналогично электрону в атоме водорода. При этом энергия электрона оказывается зависящей не только от , как в атоме водорода, но и от ; от и она по-прежнему не зависит. Электроны с данными и в многоэлектронном атоме имеют одинаковую энергию и образуют определённую электронную оболочку. Такие эквивалентные электроны и образованные ими оболочки обозначают, как и квантовые состояния и уровни энергии с заданными и , символами (для ) и говорят о -электронах, -oболочках и т. п.
Согласно принципу Паули, любые 2 электрона в атоме должны находиться в различных квантовых состояниях и, следовательно, отличаться хотя бы одним из четырёх квантовых чисел , , и , а для эквивалентных электронов ( и одинаковы) – значениями и . Число пар , , т. е. число различных квантовых состояний электрона с заданными и , и есть степень вырождения его уровня энергии . Оно определяет число электронов в полностью заполненных электронных оболочках. Таким образом, оболочки заполняются электронами, независимо от значения . Электроны с данным образуют слой, состоящий из оболочек с и заполняемый электронами, т. н. -, -, -, -слой. При полном заполнении имеем:
В каждом слое оболочки с меньшими характеризуются бoльшей электронной плотностью. Прочность связи электрона с ядром уменьшается с увеличением , а при заданном – с увеличением . Чем слабее связан электрон в соответствующей оболочке, тем выше лежит его уровень энергии. Ядро с заданным присоединяет электроны в порядке уменьшения прочности их связи: сначала два электрона , затем два электрона , шесть электронов и т. д. Атому каждого химического элемента присуще определённое распределение электронов по оболочкам – его электронная конфигурация, например:
(число электронов в данной оболочке указывается индексом справа сверху).
Периодичность в свойствах элементов определяется сходством внешних электронных оболочек атома. Например, нейтральные атомы имеют по три -электрона во внешней электронной оболочке, подобно атому , и схожи с ним по химическим и многим физическим свойствам.
Каждый атом характеризуется нормальной электронной конфигурацией, получающейся, когда все электроны в атоме связываются наиболее прочно, и возбуждёнными электронными конфигурациями, когда один или несколько электронов связаны более слабо – находятся на более высоких уровнях энергии. Например, для атома гелия наряду с нормальной возможны возбуждённые электронные конфигурации: (возбуждён один электрон), (возбуждены оба электрона). Определённой электронной конфигурации соответствует один уровень энергии атома в целом, если электронные оболочки целиком заполнены (например, нормальная конфигурация атома ), и ряд уровней энергии, если имеются частично заполненные оболочки (например, нормальная конфигурация атома азота , для которой оболочка заполнена наполовину). При наличии частично заполненных - и-oболочек число уровней энергии, соответствующих каждой конфигурации, может достигать многих сотен, так что схема уровней энергии атома с частично заполненными оболочками получается очень сложной. Основным уровнем энергии атома является самый нижний уровень нормальной электронной конфигурации.
Квантовые переходы в атоме
При квантовых переходах атом переходит из одного стационарного состояния в другое – с одного уровня энергии на другой. При переходе с более высокого уровня энергии на более низкий атом отдаёт энергию , при обратном переходе получает её. Как для любой квантовой системы, для атома квантовые переходы могут быть двух типов: с излучением (оптические переходы) и без излучения (безызлучательные, или неоптические, переходы). Важнейшая характеристика квантового перехода – его вероятность, определяющая, как часто этот переход может происходить.
При квантовых переходах с излучением атом поглощает (переход ) или испускает (переход ) электромагнитное излучение. Электромагнитная энергия поглощается и испускается атомом в виде кванта света – фотона, – характеризуемого определённой частотой колебаний , согласно соотношению: где – энергия фотона. Соотношение (7) представляет собой закон сохранения энергии для микроскопических процессов, связанных с излучением.
Атом в основном состоянии может только поглощать фотоны, а в возбуждённых состояниях может как поглощать, так и испускать их. Свободный атом в основном состоянии может существовать неограниченно долго. Продолжительность пребывания атома в возбуждённом состоянии (время жизни этого состояния) ограничена, атом спонтанно (самопроизвольно), частично или полностью теряет энергию возбуждения, испуская фотон и переходя на более низкий уровень энергии; наряду с таким спонтанным испусканием возможно и вынужденное испускание, происходящее, подобно поглощению, под действием фотонов той же частоты. Время жизни возбуждённого атома тем меньше, чем больше вероятность спонтанного перехода, для атома водорода оно порядка 10−8 с.
Совокупность частот возможных переходов с излучением определяет атомный спектр соответствующего атома: совокупность частот переходов с нижних уровней на верхние – его спектр поглощения, совокупность частот переходов с верхних уровней на нижние – спектр испускания. Каждому такому переходу в атомном спектре соответствует определённая спектральная линия частоты .
При безызлучательных квантовых переходах атом получает или отдаёт энергию при взаимодействии с другими частицами, с которыми он сталкивается в газе или длительно связан в молекуле, жидкости или твёрдом теле. В газе атом можно считать свободным в промежутках времени между столкновениями; во время столкновения (удара) атом может перейти на более низкий или высокий уровень энергии. Такое столкновение называется неупругим (в противоположность упругому столкновению, при котором изменяется только кинетическая энергия поступательного движения атома, а его внутренняя энергия остаётся неизменной). Важный частный случай – столкновение свободного атома с электроном; обычно электрон движется быстрее атома, время столкновения очень мало и можно говорить об электронном ударе. Возбуждение атома электронным ударом является одним из методов определения его уровней энергии.
Химические и физические свойства атома
Большинство свойств атома определяется строением и характеристиками его внешних электронных оболочек, в которых электроны связаны с ядром сравнительно слабо (энергии связи от нескольких электронвольт до нескольких десятков электронвольт). Строение внутренних оболочек атома, электроны которых связаны гораздо прочнее (энергии связи в сотни, тысячи и десятки тысяч электронвольт), проявляется лишь при взаимодействиях атомов с быстрыми частицами и фотонами больших энергий (более сотен электронвольт). Такие взаимодействия определяют рентгеновские спектры атома и рассеяние быстрых частиц (см. Дифракция частиц). От массы атома зависят его механические свойства при движении атома как целого – количество движения, кинетическая энергия. От механических и связанных с ними магнитных и электрических моментов атома зависят различные резонансные и другие физические свойства атома (см. Электронный парамагнитный резонанс, Ядерный магнитный резонанс, Ядерный квадрупольный резонанс).
Электроны внешних оболочек атома легко подвергаются внешним воздействиям. При сближении атомов возникают сильные электростатические взаимодействия, которые могут приводить к образованию химической связи. Более слабые электростатические взаимодействия двух атомов проявляются в их взаимной поляризации – смещении электронов относительно ядер, наиболее сильном для слабо связанных внешних электронов. Возникают поляризационные силы притяжения между атомами, которые надо учитывать уже на больших расстояниях между ними. Поляризация атома происходит и во внешних электрических полях; в результате уровни энергии атома смещаются и, что особенно важно, вырожденные уровни энергии расщепляются (эффект Штарка). Поляризация атома может возникнуть под действием электрического поля световой (электромагнитной) волны; она зависит от частоты света, что обусловливает зависимость от неё и показателя преломления (см. Дисперсия света), связанного с поляризуемостью атома. Тесная связь оптических характеристик атома с его электрическими свойствами особенно ярко проявляется в его оптических спектрах.
Магнитные свойства атома определяются в основном строением их электронных оболочек. Магнитный момент атома зависит от его механического момента (см. Магнитомеханическое отношение), в атоме с полностью заполненными электронными оболочками он равен нулю, так же как и механический момент. Атомы с частично заполненными внешними электронными оболочками обладают, как правило, отличными от нуля магнитными моментами и являются парамагнитными. Во внешнем магнитном поле все уровни атома, у которых магнитный момент не равен нулю, расщепляются – имеет место эффект Зеемана. Все атомы обладают диамагнетизмом, который обусловлен возникновением у них магнитного момента под действием внешнего магнитного поля (т. н. индуцированного магнитного момента, аналогичного электрическому дипольному моменту атома).
При последовательной ионизации атома, т. е. при отрыве его электронов, начиная с самых внешних в порядке увеличения прочности их связи, соответственно изменяются все свойства атома, определяемые его внешней оболочкой. Внешними становятся всё более прочно связанные электроны; в результате сильно уменьшается способность атома поляризоваться в электрическом поле, увеличиваются расстояния между уровнями энергии и частоты оптических переходов между этими уровнями (что приводит к смещению спектров в сторону всё более коротких длин волн). Ряд свойств обнаруживает периодичность: сходными оказываются свойства ионов с аналогичными внешними электронами; например, (два электрона ) обнаруживают сходство с (два электрона ). Это относится к характеристикам и относительному расположению уровней энергии и к оптическим спектрам, к магнитным моментам атомов и т. д. Наиболее резкое изменение свойств происходит при удалении последнего электрона из внешней оболочки, когда остаются лишь полностью заполненные оболочки, например при переходе от к (электронные конфигурации и ). В этом случае ион наиболее устойчив и его полный механический и полный магнитный моменты равны нулю.
Свойства атома, находящегося в связанном состоянии (например, входящего в состав молекулы), отличаются от свойств свободного атома. Наибольшие изменения претерпевают свойства атома, определяемые самыми внешними электронами, принимающими участие в присоединении данного атома к другому. Вместе с тем свойства, определяемые электронами внутренних оболочек, могут практически не измениться, как это имеет место для рентгеновских спектров. Некоторые свойства атомов могут испытывать сравнительно небольшие изменения, по которым можно получить информацию о характере взаимодействий связанных атомов. Важным примером может служить расщепление уровней энергии атомов в кристаллах и комплексных соединениях, которое происходит под действием электрических полей, создаваемых окружающими ионами.
Экспериментальные методы исследования структуры атома, его уровней энергии, его взаимодействий с другими атомами, элементарными частицами, молекулами, внешними полями и т. д. разнообразны, однако основная информация содержится в его спектрах. Методы атомной спектроскопии во всех диапазонах длин волн, и в особенности методы современной лазерной спектроскопии, позволяют изучать всё более тонкие эффекты, связанные с атомами. С начала 19 в. существование атома для учёных было очевидным, однако эксперимент по доказательству реальности его существования был поставлен Ж. Перреном в начале 20 в. С развитием микроскопии появилась возможность получать изображения атома на поверхности твёрдых тел. Впервые атом увидел Э. Мюллер (США, 1955) с помощью изобретённого им автоионного микроскопа. Современные атомно-силовые и туннельные микроскопы позволяют получать изображения поверхностей твёрдых тел с хорошим разрешением на атомном уровне (см. рис. 3).
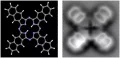 Рис. 3. Атомная структура образца хлорида натрия (NaCl), искусственно выращенного на металлической подложке (слева) и его изображение, полученное с помощью бесконтактной атомно-силовой микроскопии.Существуют и широко используются в различных исследованиях т. н. экзотические атомы, например мюонные атомы, т. е. атомы, в которых все или часть электронов заменены отрицательными мюонами, мюоний, позитроний, а также адронные атомы, состоящие из заряженных пионов, каонов, протонов, дейтронов и др. Осуществлены также первые наблюдения атома антиводорода (2002) – атома, состоящего из позитрона и антипротона.
Рис. 3. Атомная структура образца хлорида натрия (NaCl), искусственно выращенного на металлической подложке (слева) и его изображение, полученное с помощью бесконтактной атомно-силовой микроскопии.Существуют и широко используются в различных исследованиях т. н. экзотические атомы, например мюонные атомы, т. е. атомы, в которых все или часть электронов заменены отрицательными мюонами, мюоний, позитроний, а также адронные атомы, состоящие из заряженных пионов, каонов, протонов, дейтронов и др. Осуществлены также первые наблюдения атома антиводорода (2002) – атома, состоящего из позитрона и антипротона.
