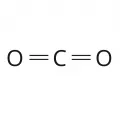Диоксид углерода
Диокси́д углеро́да (углекислый газ, угольный ангидрид, углекислота, двуокись углерода), оксид углерода(IV), химическое соединение углерода с кислородом, СО2.
Физико-химические свойства
Бесцветный газ со слабым запахом; плотность 1,9768 г/дм3 (0 °C). При давлении 5,7 МПа и температуре 20 °C сжижается; при атмосферном давлении и температуре –78,5 °C превращается в белую снегообразную массу – «сухой лёд» (при возгонке поглощает около 590 кДж/кг теплоты); при высоких давлениях образует стеклообразную массу. Растворяется в воде (1,45 г/дм3 при 25 °C и 100 кПа), образуя угольную кислоту. Жидкий диоксид углерода хорошо растворим в эфире и низших спиртах. Термически устойчив. Обладает свойствами кислотных оксидов. Взаимодействует при нагревании с углеродом, выделяя оксид углерода (реакция Будуара), а также с органическими веществами (карбоксилирование). При концентрации в воздухе свыше 6 % токсичен.
Нахождение в природе
Диоксид углерода содержится в атмосфере Земли (около 0,03 % по объёму; атмосфера Венеры содержит около 96 % СО2, Марса 95 % СО2). Выделяется с вулканическими газами, с парáми горячих источников и гейзеров, при горении и разложении растительных и животных остатков, при спиртовом брожении, горении топлива, при термическом разложении карбонатов и их взаимодействии с кислотами. Участвует в биогеохимическом углеродном цикле; является одним из источников жизни на Земле, выделяется при дыхании человека и животных, участвует в процессах фотосинтеза у растений, водорослей и цианобактерий; влияет на климат Земли (входит в состав парниковых газов).
Получение
Диоксид углерода получают в основном как побочный продукт при получении водорода из углеродсодержащего сырья.
Применение
Используют при синтезе мочевины, метанола, карбонатов и гидрокарбонатов металлов, карбоновых кислот и их производных. В пищевой промышленности применяют для охлаждения продуктов и приготовления газированных напитков, в химии – как сверхкритический растворитель, в пожарном деле – как средство огнетушения.