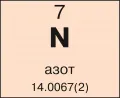
Азот
Азо́т (от а... и греч. ζωός – живой; лат. Nitrogenium), N, химический элемент V группы короткой формы (15-й группы длинной формы) периодической системы, атомный номер 7, атомная масса 14,00672. В природе два стабильных изотопа: 14N (99,635 %) и 15N (0,365 %).
Историческая справка
В 1772 г. шотландский химик Д. Резерфорд впервые описал свойства газа, не поддерживающего горения и дыхания, и назвал его «удушливым воздухом». В 1787 г. А. Л. де Лавуазье установил, что «удушливый» газ, входящий в состав воздуха, является простым веществом и предложил для него название «азот» (буквально – безжизненный). В 1784 г. Г. Кавендиш показал, что азот входит в состав селитры; в 1790 г. было предложено латинское название азот (от позднелат. nitrum – селитра и греч. γεννάω – рождать). К началу 19 в. окончательно сложилось понятие о химической инертности азота в свободном состоянии и выяснена важная роль связанного азота.
Распространённость в природе
В атмосфере азота около 3,9·1015 т; основная его часть находится в свободном состоянии (в воздухе азота 75,6 % по массе, 78,09 % по объёму); также присутствуют незначительное количества азота в связанном состоянии в виде аммиака и оксидов. Общее содержание азота в земной коре 1·10–2 % по массе. В связанном состоянии азот встречается главным образом в виде нитратов (селитры) и аммониевых соединений. Промышленный интерес представляют натриевая (чилийская) селитра NaNO3 и калиевая (индийская) селитра KNO3, значительные скопления которых встречаются в районах с сухим пустынным климатом. Азот обнаружен в составе газовых облаков комет, в туманностях и в атмосфере Солнца. В небольших количествах содержится в каменном угле (1,0–2,5 %), нефти (0,2–1,7 %), в водах рек, морей, океанов. Азот входит в состав всех живых организмов. В белках растений и животных содержится до 17 % азота, в организме человека в целом – около 3 %.
В природе осуществляется круговорот азота главным образом в результате жизнедеятельности нитрофицирующих, денитрофицирующих, азотфиксирующих микроорганизмов. Накопление азота в почве за счёт связывания свободного азота недостаточно при современной культуре земледелия, т. к. вынос азота из почвы с урожаем превосходит накопление. Проблема связывания атмосферного азота, важная как для сельского хозяйства, так и для многих отраслей промышленности, была решена в начале 20 в. с освоением промышленного синтеза аммиака.
Свойства
Конфигурация внешней электронной оболочки атома азота 2s22p3; степени окисления от –3 до +5; электроотрицательность по Полингу 3,05; радиусы (в пм): атомный 71, ковалентный (простая связь) 70, ван-дер-ваальсов 154. В свободном состоянии азот образует двухатомную молекулу N2, в которой атомы связаны тройной химической связью (длина 110 пм). Молекула азота очень устойчива (энергия термической диссоциации 941,64 кДж/моль), поэтому диссоциация в заметной степени происходит лишь при высоких температурах; например, при 3000 °C диссоциирует на атомы лишь 0,1 % молекул.
Азот – неметалл, газ без цвета и запаха; tпл –209,86 °C, tкип –195,75 °C, плотность в твёрдом состоянии 1026 кг/м3 (при –252,15 °C), в жидком 808 кг/м3 (–195,75 °C), в газообразном 1,2506 кг/м3 (0 °C); критическая температура –146,95 °C, критическое давление 3,9 МПа, критическая плотность 304 кг/м3. В твёрдом состоянии при нормальном давлении и температуре ниже –238,15 °C устойчива α-форма с кубической решёткой (плотность 1026,5 кг/м3), выше –238,15 °C – β-форма с гексагональной решёткой (плотность 879,2 кг/м3); при давлении выше 350 МПа существует третья модификация с тетрагональной кристаллической решёткой. Растворимость азота в воде 0,0291 кг на 1 м3 (при 0 °C). В некоторых углеводородах (например, гексане, гептане) азот растворим лучше, чем в воде.
В нижних слоях стратосферы под действием нейтронного космического излучения изотоп 14N превращается в радионуклид углерода 14C. В термоядерных реакциях в звёздах азот участвует в углеродно-азотном цикле.
При нормальных условиях молекулярный азот химически инертен. С большинством простых веществ азот вступает в реакции при высоких температуре, давлении и в присутствии катализаторов. При температуре 400–500 °C азот взаимодействует со щелочными и щёлочноземельными металлами. При высоких температурах азот окисляет многие металлы и неметаллы, образуя нитриды. С водородом азот реагирует при высоких температуре и давлении в присутствии катализатора на основе металлического железа с образованием аммиака. Кроме аммиака, известны другие многочисленные соединения азота с водородом, например гидразин, азотистоводородная кислота (последняя с металлами образует азиды металлов). Нитриды галогенов и серы получают только косвенными способами, например NF3 при взаимодействии фтора с аммиаком, N2S4 при взаимодействии жидкой серы с аммиаком. В большинстве случаев эти соединения малоустойчивы, часто взрывчаты; более устойчивы оксогалогениды, диоксогалогениды азота (например, NOCl, NO2Cl). При высоких температурах азот реагирует с углеродом (с раскалённым коксом), образуя дициан (CN)2. Нагреванием азота с ацетиленом до 1500 °C получают циановодород HCN. Азот окисляется кислородом с образованием оксидов; непосредственным взаимодействием с кислородом при температурах выше 2000 °C можно получить только NO, который далее окисляется до NO2. К кислородсодержащим соединениям азота относятся также азотистая кислота HNO2 и азотная кислота (и их соли, соответственно нитриты и нитраты).
Реакционная способность молекулы азота может быть значительно увеличена за счёт связывания её в комплексы с соединениями переходных металлов (Ti, V, Cr, Mo, Fe); при этом молекула N2 активируется и сравнительно легко вступает в реакции при нормальных температуре и давлении с образованием аммиака, гидразина или ароматических аминов. Под воздействием электрического разряда при давлении 130–260 Па или при взрыве смеси кислорода и оксида углерода в присутствии азота образуется активный азот (смесь атомов и молекул азота, обладающих повышенной энергией), который при комнатной температуре взаимодействует с атомарными кислородом, водородом, парами серы, фосфора, некоторыми металлами. Азот входит в состав многих органических соединений – амидов, аминов, нитрилов, нитросоединений и др.
Получение и применение
 Работа с жидким азотом.Азот в лаборатории может быть получен при нагревании водного раствора нитрита аммония: NH4NO2 = N2+2H2O. В промышленности азот извлекают из воздуха путём его глубокого охлаждения до жидкого состояния с последующим разделением, например, методом ректификации. Основная область использования азота – синтез аммиака с последующим получением из него азотной кислоты, удобрений и многих других веществ, содержащих связанный азот. Свободный азот применяют как инертную среду в химических и металлургических процессах, при перекачке горючих жидкостей и др.; жидкий азот – хладагент. Газообразный азот хранят и транспортируют в сжатом виде в стальных баллонах, жидкий азот – в сосудах Дьюара.
Работа с жидким азотом.Азот в лаборатории может быть получен при нагревании водного раствора нитрита аммония: NH4NO2 = N2+2H2O. В промышленности азот извлекают из воздуха путём его глубокого охлаждения до жидкого состояния с последующим разделением, например, методом ректификации. Основная область использования азота – синтез аммиака с последующим получением из него азотной кислоты, удобрений и многих других веществ, содержащих связанный азот. Свободный азот применяют как инертную среду в химических и металлургических процессах, при перекачке горючих жидкостей и др.; жидкий азот – хладагент. Газообразный азот хранят и транспортируют в сжатом виде в стальных баллонах, жидкий азот – в сосудах Дьюара.