Винные кислоты
Ви́нные кисло́ты (дигидроксиянтарные кислоты, α, β-диоксиянтарные кислоты, 2,3-дигидроксибутандиовые кислоты), двухосно́вные насыщенные алифатические гидроксикислоты, дигидроксидикарбоновые кислоты, альдаровые кислоты, HOOCCH(OH)CH(OH)COOH. Молекула содержит два асимметрических атома углерода. Винные кислоты существуют в виде трёх стереоизомеров: энантиомерных D-(–)- и L-(+)-винных кислот и их диастереомера – оптически неактивной мезовинной кислоты.
Таблица 1. Номенклатура винных кислот
Название | Винные кислоты | |||
Историческое | D-винная кислота, d-винная кислота (от лат. dextro – правый), виннокаменная кислота, обыкновенная винная кислота | L-винная кислота, l-винная кислота (от лат. laevo – левый) | Мезовинная кислота, антивинная кислота, i-винная кислота | DL-винная кислота, рацемическая винная кислота, виноградная кислота |
По оптической активности | (+) | (–) | 0 | 0 |
По абсолютной конфигурации | (2R, 3R) | (2S, 3S) | (2R, 3S) | (2RS, 3RS) |
По относительной конфигурации | L | D | н/о | DL |
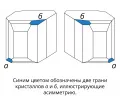 Кристаллы зеркальных изомеров натрийаммониевой соли винной кислоты.
Кристаллы зеркальных изомеров натрийаммониевой соли винной кислоты.
Используя винные кислоты, французский химик и микробиолог Л. Пастер в середине 1840-х гг. провёл исследования по расщеплению рацемических соединений. В природе встречается L-(+)-винная кислота, которая в свободном виде и в виде солей содержится во многих фруктах и ягодах. Соли и эфиры винной кислоты называются тартратами. Молярная масса 150,09 г/моль.
Физико-химические свойства
Винные кислоты – бесцветные кристаллические вещества, растворимые в воде, этаноле, малорастворимые в диэтиловом эфире (детальные данные приведены в таблице 2). Для L-(+)-винной кислоты известно, что она также растворяется в метаноле, ацетоне, не растворяется в хлороформе, бензоле.
Таблица 2. Физические свойства винных кислот
Параметр | L-(+)-винная кислота | D-(–)-винная кислота | Мезовинная кислота | DL-винная кислота |
Плотность (г/см3) | 1,7598 | 1,7598 | 1,666 | 1,697 |
tплав (°C) | 170 | 170 | 140 | 205 |
Удельное вращение в 20 %-ном водном растворе при 20 °C (°) | +11,98 | –11,98 | 0 | 0 |
Растворимость в воде (г/100 мл) | 139 (20 °C) 147 (25 °C) 343 (100 °C) | 139 (20 °C) 147 (25 °C) 343 (100 °C) | 125 (15 °C) 167 (25 °C)
| 9,23 (0 °C) 20,6 (20 °C) 25 (25 °C) 185 (100 °C) |
Растворимость в этаноле (г/100 мл) | 25,6 (15 °C) | 25,6 (15 °C) | растворима | 2,08 (15 °C) 3,95 (25 °C) |
Растворимость в диэтиловом эфире (г/100 мл) | 0,39 (15 °C) | 0,39 (15 °C) | малорастворима | 1,08 (15 °C) |
pKa1 при 25 °C | 2,89 | 2,89 | 3,22 | 2,99 |
pKa2 при 25 °C | 4,16 | 4,16 | 4,85 | 4,40 |
DL-винная кислота кристаллизуется в виде моногидрата, который теряет воду при нагревании до 100 °C. Безводная форма может быть получена при перекристаллизации из воды при температуре выше 73 °C или из этанола. Мезовинная кислота также кристаллизуется в виде моногидрата, который теряет воду при нагревании до 110 °C.
Винные кислоты проявляют свойства, характерные для карбоновых кислот и многоатомных спиртов. Возможно образование сложных эфиров двух типов, в реакциях этерификации винные кислоты принимают участие и как кислоты, и как спирты. Карбоксильная группа (-СООН) участвует в образовании солей, может быть превращена в нитрильную или амидную. Как многоатомные спирты винные кислоты образуют хелатный комплекс тёмно-синего цвета с гидроксидом меди(II) (реактив Фелинга).
Нагревание L-(+)-винной кислоты до 170–180 °C приводит первоначально к образованию метавинной кислоты, а при дальнейшем нагревании – ангидрида. При пиролизе L-(+)-винной кислоты образуются пировиноградная и пировинная кислоты. Частичное восстановление L-(+)-винной кислоты даёт яблочную кислоту, энергичное восстановление иодоводородом – янтарную кислоту. L-(+)-винная кислота чувствительна по отношению к окислителям, она восстанавливает аммиачный раствор нитрата серебра, окисляется сильными окислителями до щавелевой кислоты, фотохимически в присутствии урановых солей – до глиоксаля, перекисью водорода и солями железа – до диоксималеиновой кислоты.
L-(+)- и D-(–)-винные кислоты при нагревании в кислых, нейтральных и особенно быстро в щелочных средах образуют смесь оптически недеятельных виноградной и мезовинной кислот. Виноградная и мезовинная кислоты взаимопревращаемы.
Винные кислоты обладают хелатирующими свойствами.
 Образец винного камня.
Образец винного камня.
Способы получения
L-(+)-винную кислоту получают действием минеральных кислот на гидротартрат калия HOOCCH(OH)CH(OH)COOK – винный камень, осаждающийся при хранении вин.
Виноградную кислоту синтезируют, окисляя малеиновую кислоту, её соли или ангидрид. Она также образуется (в смеси с мезовинной) при кипячении раствора L-(+)-винной кислоты со щёлочью.
Мезовинная кислота получается при нагревании виноградной кислоты до 130 °C с соляной кислотой.
D-(–)-винную кислоту получают расщеплением рацемата.
Применение
Винные кислоты и их соли применяют в пищевой (пищевые добавки Е334–337, регуляторы кислотности, подкислители, антиоксиданты, эмульгаторы, связующие агенты), фармацевтической (как регуляторы кислотности, антиоксиданты) и текстильной (в качестве протравы при окрашивании тканей) промышленности, металлообработке, гальванопластике, при производстве цемента, полимерных материалов (диэтилтартрат – растворитель, пластификатор), в аналитической химии.
Содержание в продуктах питания
Таблица 3. Содержание винной кислоты в продуктах питания
| Наименование продукта | Винная кислота, г/100 г продукта |
Овощи, плоды, ягоды | Виноград | 0,4 |
Томаты грунтовые | 0,04 | |
Облепиха | 0,03 | |
Яблоки | 0,01 | |
Плодоовощные консервы и пищевые концентраты | Сок виноградный | 0,41 |
Паста яблочно-чёрносмородиновая с сахаром | 0,16 | |
Сок облепиховый | 0,03 | |
Сок яблочный | 0,01 |
Виноградные вина содержат до 0,6 % винной кислоты.
Количество винной кислоты в винограде уменьшается по мере его созревания с 13,9 г/л в середине июля до 6,5 г/л в начале октября.
