Карбоновые кислоты
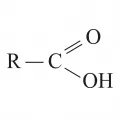
Карбо́новые кисло́ты, органические соединения, содержащие в молекулах карбоксильную группу (карбоксил) COOH. Широко распространены в природе в свободном состоянии и в виде производных: находятся в плодах некоторых растений, крови, выделениях животных; входят в состав жиров, эфирных масел, восков; играют важную роль в обмене веществ. Многие карбоновые кислоты имеют тривиальные названия, которые связаны в основном с их нахождением в природе, например муравьиная кислота (или, в соответствии с правилами химической номенклатуры, метановая кислота), валериановая кислота (пентановая кислота), янтарная кислота (бутандиовая кислота).
В зависимости от типа радикала R, связанного с группой COOH, карбоновые кислоты могут быть алифатическими (например, уксусная кислота), алициклическими (циклогексанкарбоновая кислота C6H11COOH), ароматическими (толуиловые кислоты) или гетероциклическими (никотиновая кислота); кроме того, карбоновые кислоты могут быть насыщенными (пропановая, или пропионовая, кислота) и ненасыщенными (пропеновая, или акриловая, кислота). Алифатические карбоновые кислоты, у которых число атомов С в молекуле больше 6, относят к высшим жирным кислотам. По числу карбоксильных групп в молекуле различают одно-, двух-, …, многоосновные (соответственно моно-, ди-, …, поликарбоновые) кислоты, например ряд бензолкарбоновых кислот: бензойная кислота (монокарбоновая), фталевые кислоты (дикарбоновые), тримезиновая кислота (1,3,5-бензолтрикарбоновая), пиромеллитовая кислота (1,2,4,5-бензолтетракарбоновая), 1,2,3,4,5-бензолпентакарбоновая кислота, меллитовая кислота (бензолгексакарбоновая). Карбоновые кислоты кроме карбоксильных групп могут содержать другие функциональные группы, например NH2 (аминокислоты), C=O (оксокислоты), OH (гидроксикислоты), атомы галогенов (галогенкарбоновые кислоты).
Карбоксильная группа имеет планарное строение и такое перераспределение электронной плотности за счёт мезомерного и индуктивного эффектов, которое способствует тому, что в твёрдом и жидком состоянии молекулы карбоновых кислот образуют прочные водородные связи и карбоновые кислоты существуют в виде устойчивых циклических димеров.
Димеризацией обусловлены более высокие температуры плавления и кипения карбоновых кислот по сравнению с соединениями с близкой молекулярной массой, но не содержащими групп COOH. Карбоновые кислоты – жидкие (одноосновные низшие алифатические, многие ненасыщенные кислоты) или твёрдые вещества. Низшие алифатические карбоновые кислоты хорошо растворимы в воде, ароматические карбоновые кислоты – ограниченно, высшие жирные кислоты в воде нерастворимы, растворяются в спирте, эфире, бензоле.
В основном карбоновые кислоты – слабые кислоты, их кислотные свойства обусловлены способностью диссоциировать в водном растворе: . Степень диссоциации, а следовательно, и сила кислот, зависят от размера и природы радикала, связанного с карбоксилом. С увеличением длины углеводородного радикала сила кислот уменьшается; например, при 25 °C константа диссоциации Ka муравьиной кислоты 1,7·10–4, пропионовой кислоты 1,3·10–5. Кислотность повышается при введении в молекулы карбоновых кислот электроноакцепторных заместителей (OH, NO2, CN, Cl, F и др.), например Ka уксусной кислоты 1,7·10–5, Ka трифторуксусной кислоты CF3COOH 5,9·10–1. Кислотность дикарбоновых кислот выше, чем монокарбоновых; кислотность ненасыщенных и ароматических карбоновых кислот выше, чем насыщенных (например, акриловая кислота примерно в 4 раза сильнее пропионовой). Влияние заместителей (в том числе второй карбоксильной группы) и кратных связей тем больше, чем они ближе расположены к карбоксильной группе; например, щавелевая кислота HOOC-COOH примерно в 40 раз сильнее малоновой кислоты HOOC-CH2-COOH.
Наиболее важные химические свойства карбоновых кислот – способность превращаться в производные. При взаимодействии карбоновых кислот с металлами, их оксидами и гидроксидами образуются соли, например: . Натриевые и калиевые соли карбоновых кислот хорошо растворимы в воде; соли высших высших карбоновых кислот называются мылами. При взаимодействии карбоновых кислот со спиртами в присутствии минеральных кислот образуются сложные эфиры: ( – алкильный радикал); c галогенангидридами минеральных кислот – ацилгалогениды, например: . При нагревании карбоновых кислот с водоотнимающими средствами обычно получаются ангидриды карбоновых кислот. Взаимодействие карбоновых кислот, их ангидридов, эфиров и хлорангидридов с аминами и аммиаком приводит к амидам карбоновых кислот, например: .
Большинство карбоновых кислот и их солей подвергается декарбоксилированию. Восстановление карбоновых кислот приводит к альдегидам и далее к первичным спиртам. Многие карбоновые кислоты вступают в реакции полимеризации и поликонденсации. Например, полимеризацией акриловой кислоты получают полиакриловую кислоту, полимеризацией эфиров, нитрила, амида акриловой кислоты – полиакрилаты, полиакрилонитрил, полиакриламид; сополимеризацией акриловой кислоты с виниловыми мономерами – акрилатные каучуки. Поликонденсацией дикарбоновых кислот (адипиновой кислоты, фталевых кислот, себациновой кислоты, малеиновой и фумаровой кислот и др.), их ангидридов или эфиров с гликолями получают сложные полиэфиры (полиэтилентерефталат и др.); поликонденсацией адипиновой и ряда других кислот с диаминами – полиамиды.
Наиболее общими способами получения карбоновых кислот являются процессы окисления и гидролиза. Окислением насыщенных углеводородов воздухом (или кислородом) при температуре 100–500 °С, давлении до 20 МПа, обычно в присутствии катализатора, получают алифатические насыщенные карбоновые кислоты, например: . Ненасыщенные углеводороды окисляются по месту двойной связи: . Окислением боковой цепи алкиларенов получают ароматические карбоновые кислоты, например окислением толуола – бензойную кислоту.
Карбоновые кислоты получают также окислением первичных спиртов, альдегидов и кетонов (в том числе по реакции Канниццаро); например, адипиновую кислоту получают окислением циклического кетона циклогексанона.
Карбоновые кислоты получают гидролизом нитрилов, амидов, сложных эфиров; в частности, при щелочном гидролизе (омылении) природных жиров образуются соли, из которых в промышленности получают пальмитиновую кислоту, стеариновую кислоту, олеиновую кислоту и др. Некоторые карбоновые кислоты (например, уксусная, пропионовая, масляная) образуются при брожении углеводов в присутствии бактерий определённого вида. Для получения карбоновых кислот используют также процессы карбонилирования, гидроформилирования и карбоксилирования.
Карбоновые кислоты и их производные широко используют как пластификаторы, эмульгаторы, смазочные материалы, ингибиторы коррозии, антиоксиданты и др. в разных отраслях промышленности. Карбоновые кислоты – исходные вещества и полупродукты в промышленном органическом синтезе (в производстве поверхностно-активных веществ, лакокрасочных, резинотехнических изделий, красителей и лекарственных средств), мономеры для синтеза волокон, пластмасс и каучуков.