Альдегиды
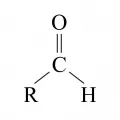
Альдеги́ды [от новолат. al(cohol)dehyd(rogenatum) – алкоголь, лишённый водорода], органические соединения, содержащие альдегидную группу. Общая формула RCH=O (R – водород или органический радикал); относятся к карбонильным соединениям.
Физико-химические свойства
Первый член гомологического ряда – формальдегид – газ, остальные альдегиды – жидкости, реже твёрдые вещества. Низшие альдегиды имеют резкий запах, смешиваются с водой в любых соотношениях; с увеличением молекулярной массы растворимость альдегидов в воде падает. Большинство альдегидов хорошо растворимы в этиловом спирте.
Альдегиды характеризуются высокой реакционной способностью, легко окисляются кислородом воздуха по свободнорадикальному механизму в соответствующие кислоты (промежуточный продукт – пероксикислоты):
Альдегиды восстанавливаются в первичные спирты под действием водорода (катализатор – платина или никель), LiAlH4 или NaBH4, например:
Под действием амальгамы цинка в концентрированной соляной кислоте идёт восстановление альдегидов в соответствующие углеводороды (реакция Клемменсена). В присутствии щелочей происходит окислительно-восстановительное диспропорционирование альдегидов с образованием соответствующих спиртов и кислот (реакция Канниццаро). Простейший диальдегид – глиоксаль – легко подвергается внутримолекулярной окислительно-восстановительной реакции с образованием гликолевой кислоты. Нуклеофилы присоединяются к карбонильной группе или замещают в ней атом кислорода. Альдегиды со спиртами в кислой среде образуют ацетали RCH(OR')2, с циановодородом в присутствии основания – гидроксинитрилы (циангидрины) RCH(OH)CN, с первичными аминами – шиффовы основания (азометины) RCH=N−R'. Замещённые амины, такие как гидразин, гидроксиламин, фенилгидразин, вступают в реакцию с альдегидами подобно первичным аминам с образованием соответственно гидразонов RHC=N−NH2, оксимов RHC=NOH и фенилгидразонов RHC=N–NH−C6H5. Взаимодействие альдегидов со вторичными аминами приводит к образованию енаминов RR'C=CHNRR'. Реакцию присоединения гидросульфита натрия NaHSO3 к альдегидам с образованием кристаллического, т. н. бисульфитного, соединения RCH(OH)SO3Na используют для очистки альдегидов (с последующей регенерацией нагреванием с раствором соды или с разбавленной кислотой). Важное значение имеет реакция Гриньяра, позволяющая получать из альдегидов первичные и вторичные спирты. Низшие альдегиды легко полимеризуются. Взаимодействие с другими альдегидами и кетонами называется альдольно-кротоновой конденсацией, например:
Ароматические альдегиды легко вступают в подобную реакцию с ангидридами карбоновых кислот (реакция Перкина):
где Ar – арильный радикал; алифатические и ароматические альдегиды – с эфирами малоновой кислоты (реакция Кнёвенагеля). Важное значение имеет взаимодействие альдегидов с алкилиденфосфоранами, в результате которого образуются алкены преимущественно в виде Е-изомера:
Качественными реакциями на альдегиды являются образование «серебряного зеркала» при взаимодействии альдегидов с ионами серебра в аммиачном растворе и образование красного осадка оксида меди(I) при взаимодействии альдегидов с реактивом Фелинга.

Получение
Наиболее распространённый промышленный метод получения альдегидов – каталитическое дегидрирование спиртов. Альдегиды получают также каталитическим восстановлением карбоновых кислот, взаимодействием алкенов с СО и Н2 (гидроформилирование), присоединением воды к ацетилену в присутствии солей ртути (реакция Кучерова).
Применение
Альдегиды применяют в промышленном органическом синтезе спиртов и их производных, карбоновых кислот, гетероциклических соединений и др. На основе альдегидов получают полимерные материалы (например, феноло-формальдегидные смолы), фармацевтические препараты, душистые вещества. В природе альдегиды обнаружены в эфирных маслах (цитраль, ванилин и др.), зелёных листьях (2-гексеналь).