Анилин
Анили́н (франц. aniline от португ. anil, от араб. النيل – индиго; аминобензол, фениламин), простейший ароматический амин, C6H5NH2.
Историческая справка
Впервые анилин получен немецким химиком О. Унфердорбеном в 1826 г. путём сухой перегонки индиго и назван кристаллином из-за способности к образованию кристаллических солей.  Образец индиго.В 1834 г. немецкий химик Ф. Ф. Рунге выделил из каменноугольной смолы вещество, которое при обработке хлорной известью давало синий цвет, и описал его под названием «кианол». В 1840 г. Ю. Ф. Фрицше обнаружил, что при взаимодействии индиго с гидроксидом калия исчезает синий цвет и образуется жидкая масса красно-коричневого цвета; очистив её перегонкой, он выделил вязкую жидкость с характерным запахом, которую назвал анилином. В 1842 г. Н. Н. Зинин действием сульфида аммония на нитробензол (реакция Зинина) получил соединение осно́вного характера, названное им «бензидам». Сомневаясь в своём открытии, он отправил ампулу с получённым веществом Ф. Ю. Фрицще, который подтвердил сходство бензидама и анилина. В 1843 г. А. В. фон Гофман показал, что кристаллин, кианол, анилин и бензидам являются одним и тем же веществом.
Образец индиго.В 1834 г. немецкий химик Ф. Ф. Рунге выделил из каменноугольной смолы вещество, которое при обработке хлорной известью давало синий цвет, и описал его под названием «кианол». В 1840 г. Ю. Ф. Фрицше обнаружил, что при взаимодействии индиго с гидроксидом калия исчезает синий цвет и образуется жидкая масса красно-коричневого цвета; очистив её перегонкой, он выделил вязкую жидкость с характерным запахом, которую назвал анилином. В 1842 г. Н. Н. Зинин действием сульфида аммония на нитробензол (реакция Зинина) получил соединение осно́вного характера, названное им «бензидам». Сомневаясь в своём открытии, он отправил ампулу с получённым веществом Ф. Ю. Фрицще, который подтвердил сходство бензидама и анилина. В 1843 г. А. В. фон Гофман показал, что кристаллин, кианол, анилин и бензидам являются одним и тем же веществом.
В 1856 г. У. Г. Перкин-старший путём взаимодействия анилина с дихроматом калия получил мовеин (первый синтетический краситель). Позже на его основе получены и другие красители. Это открытие на долгое время определило основное промышленное применение анилина. Для производства анилина использовался способ, разработанный в 1854 г. французским химиком А. Бешаном, который заключался в восстановлении нитробензола железом в присутствии кислот (соляной и др.)
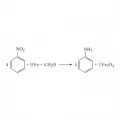 Получение анилина методом Бешана.В начале 20 в. обнаружено, что анилин ускоряет вулканизацию каучуков, а с 1960-х гг. новой и основной областью его применения стало производство полиуретанов.
Получение анилина методом Бешана.В начале 20 в. обнаружено, что анилин ускоряет вулканизацию каучуков, а с 1960-х гг. новой и основной областью его применения стало производство полиуретанов.
Физико-химические свойства
Бесцветная вязкая жидкость с характерным запахом, темнеющая на свету и воздухе; молярная масса 93,13 г/моль; tпл −6,2 °C; tкип 184,4 °C; плотность 1,022 г/см3 (при 20 °C). Анилин плохо растворяется в воде, хорошо – в этаноле, диэтиловом эфире, ацетоне, бензоле, хлороформе и других органических растворителях. Образует азеотропные смеси с большинством углеводородов и галогенуглеводородов и с водой (18 % анилина, tкип 91,5 °C).
Более слабое основание, чем аммиак и алифатические амины. Это вызвано мезомерным эффектом аминогруппы, т. е. сопряжением неподелённой пары электронов атома азота N с π-электронами бензольного ядра. При действии электрофильных реагентов в анилине легко замещаются атомы водорода H в орто- и пара-положениях.
С минеральными кислотами (например, с соляной или серной) анилин образует устойчивые соли. При взаимодействии с нитритом натрия NaNO2 в кислой среде даёт соль диазония, которая используется в синтезе азокрасителей. Образование сульфата анилина может быть использовано для защиты аминогруппы анилина от окисления на последующих стадиях синтеза.
Анилин алкилируется по атому азота алкилхлоридами, алкенами, в присутствии водорода – альдегидами и кетонами. Реакция анилина с формальдегидом в присутствии соляной кислоты используется для получения 4,4'-диаминодифенилметана, из которого синтезируют метилендифенилдиизоцианат в производстве полиуретанов. В присутствии катализаторов реагирует со спиртами с образованием моно- и диалкиланилинов. При ацилировании анилина образуются анилиды. При пропускании паров анилина над оксидом алюминия Аl2О3, а также при нагревании с соляной кислотой образуется дифениламин (C6H5)2NH, широко используемый в органическом синтезе. Взаимодействие анилина с хлороформом в растворе гидроксида калия даёт фенилизоцианид. Некоторые реакции анилина приводят к образованию гетероциклических соединений (например, хинолина). Каталитическим гидрированием анилина получают циклогексиламин (промежуточный продукт в cинтезе капролактама).
Анилин высокотоксичен, действует на центральную нервную систему, вызывает в крови образование метгемоглобина и разрушение эритроцитов (гемолиз), следствием чего является кислородное голодание организма. Проникает в организм через кожу и слизистые оболочки, в виде паров – через органы дыхания. Возможны острые и хронические отравления (анилизм). Гепатотоксичен (вызывает тяжёлые поражения печени).
Получение
Основной способ получения анилина – каталитическое (катализаторы Ni, Cu, Pd и др.) гидрирование нитробензола в газовой или жидкой фазе. Газофазное гидрирование нитробензола проводят при 250–350 °C; жидкофазное гидрирование протекает при более низких температурах (100–200 °C). Нитробензол получают нитрованием бензола смесью концентрированной азотной и серной кислот (нитрующая смесь):
Альтернативный метод синтеза представляет собой аммонолиз фенола. Процесс проводят в присутствии катализатора (Al2O3, алюмосиликат и др.) при повышенных температуре (выше 300 °C) и давлении (более 1 МПа). Выбор данного метода определяется доступностью недорогого фенола и используется производителями последнего.
Мировое производство анилина в 2022 г. составило 9,4 млн т. Лидерами по объёму производству являются Китай, США, Япония, Германия.
Применение
Анилин применяется для получения красителей и пигментов, а также в производстве ускорителей вулканизации, полиуретанов (сырьё для получения изоцианатов), взрывчатых веществ, фотоматериалов, лекарственных средств (болеутоляющих, жаропонижающих, противоаллергических средств и витаминов) и пестицидов. Также широкое применение имеют замещённые производные анилина (хлоранилины, ксилидины и др.)