Углерод
Углеро́д (лат. Сarboneum), C, химический элемент IV группы короткой формы (14-й группы длинной формы) периодической системы; атомный номер 6, атомная масса 12,0107. Природный углерод состоит из двух стабильных изотопов: 12C (98,89 %) и 13C (1,11 %). В атмосфере присутствует радиоизотоп 14C (период полураспада T1/2 5730 лет, β-излучатель), который образуется в верхних слоях атмосферы при облучении ядер 14N нейтронами космического излучения. По содержанию изотопа 14С в растительных и животных остатках определяют их возраст (радиоуглеродный метод датирования). Искусственно получены радиоизотопы с массовыми числами 8–22.
Историческая справка
Углерод в виде древесного угля применялся в глубокой древности для выплавки металлов. Издавна известны алмаз и графит. Элементарная природа углерода установлена во 2-й половине 18 в.
Распространённость в природе
 Херкимерский алмаз. Округ Херкимер (штат Нью-Йорк, США).Содержание углерода в земной коре 0,48 % по массе. В природе встречается в виде простых (алмаз, графит, фуллерены) и сложных веществ – природных карбонатов, горючих ископаемых (уголь, нефть, газ и др.), а также входит в состав растений и животных (около 17,5 %). В виде соединений с азотом и водородом углерод обнаружен в атмосфере Солнца, планет, найден в каменных и железных метеоритах. Углерод – важнейший биогенный элемент. Кругооборот углерода в природе включает выделение углекислого газа CO2 в атмосферу при окислении органических веществ и возвращение его в результате фотосинтеза растениями. С растениями углерод попадает в организм животных и человека, а затем при гниении животных и растительных материалов – в почву и в виде CO2 – в атмосферу.
Херкимерский алмаз. Округ Херкимер (штат Нью-Йорк, США).Содержание углерода в земной коре 0,48 % по массе. В природе встречается в виде простых (алмаз, графит, фуллерены) и сложных веществ – природных карбонатов, горючих ископаемых (уголь, нефть, газ и др.), а также входит в состав растений и животных (около 17,5 %). В виде соединений с азотом и водородом углерод обнаружен в атмосфере Солнца, планет, найден в каменных и железных метеоритах. Углерод – важнейший биогенный элемент. Кругооборот углерода в природе включает выделение углекислого газа CO2 в атмосферу при окислении органических веществ и возвращение его в результате фотосинтеза растениями. С растениями углерод попадает в организм животных и человека, а затем при гниении животных и растительных материалов – в почву и в виде CO2 – в атмосферу.
Свойства
Конфигурация внешних электронных оболочек атома углерода в основном состоянии 2s22p2. Сходство 2s- и 2p- атомных орбиталей по энергии и симметрии обеспечивает их взаимодействие (гибридизацию) и образование линейных sp-, треугольных sp2- и тетраэдрических sp3-гибридных орбиталей. Близость энергии этих состояний, прочность простых, двойных и тройных связей атомов углерода между собой обусловливают многообразие структур из атомов углерода, их способность образовывать устойчивые цепи и циклы и существование огромного числа углеродсодержащих соединений, изучаемых органической химией.
Степени окисления +4, –4, редко +2 (оксид углерода), +3 (циан); энергии ионизации при последовательном переходе от C0 к C4+ 1086,5, 2352,6, 4620,5, 6222,7 кДж/моль; электроотрицательность по Полингу 2,55; атомный радиус 77 пм. Сечение захвата тепловых нейтронов 3,5·10–31 м2.
 Графит. Окрестности г. Росси, округ Сент-Лоренс (штат Нью-Йорк, США). Национальный музей естественной истории (Вашингтон), Смитсоновский институт.Образует несколько кристаллических аллотропных модификаций: графит, алмаз, карбин, лонсдейлит, фуллерены, графен, графин, углеродные нанотрубки, а также несколько аморфных форм. Термодинамически наиболее стабилен графит – мягкое чёрное вещество со слоистой гексагональной структурой. Каждый слой построен из шестичленных колец, в которых три электрона атома С образуют три sp2-гибридные σ-связи в плоскости слоя. Взаимодействие этих электронов создаёт прочную систему делокализованных π-связей. Четвёртый электрон атома С находится на орбитали, перпендикулярной к слою. Прочность химических связей в слое (716 кДж/моль) гораздо выше, чем между слоями (17 кДж/моль). Такая система связей объясняет возможность превращения графита в другие полиморфные формы углерода. Известны гексагональная α-форма (tпл около 4100 К при 9 кБар; плотность 2266 кг/м3 при 20 °C) и ромбоэдрическая β-форма графита. Слоистое строение графита определяет анизотропию его свойств (например, вдоль слоя электропроводность в 5000 раз больше, чем в поперечном направлении), а также хорошие антифрикционные свойства. Удельное электрическое сопротивление вдоль плоскости слоёв порядка 10–4 Ом·см.
Графит. Окрестности г. Росси, округ Сент-Лоренс (штат Нью-Йорк, США). Национальный музей естественной истории (Вашингтон), Смитсоновский институт.Образует несколько кристаллических аллотропных модификаций: графит, алмаз, карбин, лонсдейлит, фуллерены, графен, графин, углеродные нанотрубки, а также несколько аморфных форм. Термодинамически наиболее стабилен графит – мягкое чёрное вещество со слоистой гексагональной структурой. Каждый слой построен из шестичленных колец, в которых три электрона атома С образуют три sp2-гибридные σ-связи в плоскости слоя. Взаимодействие этих электронов создаёт прочную систему делокализованных π-связей. Четвёртый электрон атома С находится на орбитали, перпендикулярной к слою. Прочность химических связей в слое (716 кДж/моль) гораздо выше, чем между слоями (17 кДж/моль). Такая система связей объясняет возможность превращения графита в другие полиморфные формы углерода. Известны гексагональная α-форма (tпл около 4100 К при 9 кБар; плотность 2266 кг/м3 при 20 °C) и ромбоэдрическая β-форма графита. Слоистое строение графита определяет анизотропию его свойств (например, вдоль слоя электропроводность в 5000 раз больше, чем в поперечном направлении), а также хорошие антифрикционные свойства. Удельное электрическое сопротивление вдоль плоскости слоёв порядка 10–4 Ом·см.
Алмаз – бесцветное прозрачное кристаллическое вещество. В его кубической структуре каждый атом углерода тетраэдрически окружён четырьмя равноудалёнными соседними атомами углерода. Благодаря симметричному распределению электронной плотности, структура алмаза отличается чрезвычайной устойчивостью; tпл 4100 К (125 кБар), плотность 3510 кг/м3 (20 °C). Из-за различного строения графит и алмаз отличаются по свойствам. По твёрдости графит относится к самым мягким веществам, алмаз – эталон максимальной твёрдости (10 баллов по шкале Мооса). Алмаз – диэлектрик (удельное электрическое сопротивление 1014–1016 Ом·см), графит имеет высокую электропроводность. При давлениях до 100 кБар и температурах 1200–2800 К графит превращается в алмаз. Этот процесс ускоряется в присутствии расплавленных металлов (Cr, Fe, Ni) и неметаллов (красный фосфор).
Лонсдейлит – кристаллическая модификация алмаза с гексагональной структурой, плотность 3510 кг/м3. Образуется из α-графита статическим сжатием при нагревании до 1000 °С; найден в метеоритах.
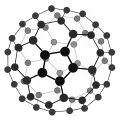 Молекула фуллерена C₆₀.Фуллерены представляют собой серию полиэдрических кластерных молекул Сn (n – чётное), в которых атомы углерода объединены в пяти- и шестиугольники. Фуллерены обнаружены в продуктах конденсации паров, образующихся при прохождении электрической дуги между графитовыми электродами при 3500 °С и низком давлении в атмосфере гелия.
Молекула фуллерена C₆₀.Фуллерены представляют собой серию полиэдрических кластерных молекул Сn (n – чётное), в которых атомы углерода объединены в пяти- и шестиугольники. Фуллерены обнаружены в продуктах конденсации паров, образующихся при прохождении электрической дуги между графитовыми электродами при 3500 °С и низком давлении в атмосфере гелия.
Карбин – мелкокристаллический порошок чёрного цвета. Атомы углерода объединяются в линейные цепочки за счёт sp-гибридных связей. Известно несколько форм карбина, отличающихся числом атомов в элементарной ячейке и плотностью (2680–3300 кг/м3). Обладает полупроводниковыми свойствами (под воздействием света проводимость сильно увеличивается). Карбин химически инертен, взаимодействует с водородом. При высоких температурах и давлениях превращается в алмаз.
Графен – двумерная аллотропная модификация углерода (её можно представить как одну плоскость графита, отделённую от объёмного кристалла). По оценкам, обладает большими механической жёсткостью (1 ТПа) и теплопроводностью (5·103 Вт·м–1·К–1). Высокая подвижность носителей заряда (максимальная подвижность электронов среди всех известных материалов) делает графен перспективным материалом для использования в наноэлектронике. Для приготовления графена используют механическое расщепление кристаллов графита. Плёнки графена синтезируют газофазным осаждением паров углерода на медную фольгу (CVD-графен). При комнатной температуре благодаря сильным ковалентным связям графен инертен по отношению к кислотам и щелочам. Протонированием в плазме газового разряда синтезируют гидриды графена, с помощью дифторида ксенона – фторографен. Углеродные наноструктуры.Углеродные нанотрубки представляют собой одну или несколько свёрнутых в трубку гексагональных графитовых плоскостей. Различают открытые и закрытые нанотрубки, которые с одного или обоих концов закрыты полусферой, напоминающей половину молекулы фуллерена. Имеют высокую электропроводность и прочность (например, модуль Юнга нанотрубки достигает величин в несколько ТПа). Помимо нанотрубок известны луковичные структуры, состоящие из нескольких концентрических сфер, организованных подобно молекуле фуллерена.
Углеродные наноструктуры.Углеродные нанотрубки представляют собой одну или несколько свёрнутых в трубку гексагональных графитовых плоскостей. Различают открытые и закрытые нанотрубки, которые с одного или обоих концов закрыты полусферой, напоминающей половину молекулы фуллерена. Имеют высокую электропроводность и прочность (например, модуль Юнга нанотрубки достигает величин в несколько ТПа). Помимо нанотрубок известны луковичные структуры, состоящие из нескольких концентрических сфер, организованных подобно молекуле фуллерена.
 Структура аморфного углерода.В аморфных формах углерода (угле, саже, стеклоуглероде) присутствуют атомы углерода в различных гибридных состояниях. Стеклоуглерод – тугоплавкий материал с высокими механической прочностью, электропроводностью, устойчивостью к агрессивным средам (кислотам, окислителям, расплавленным щелочам, солям).
Структура аморфного углерода.В аморфных формах углерода (угле, саже, стеклоуглероде) присутствуют атомы углерода в различных гибридных состояниях. Стеклоуглерод – тугоплавкий материал с высокими механической прочностью, электропроводностью, устойчивостью к агрессивным средам (кислотам, окислителям, расплавленным щелочам, солям).
При обычных температурах углерод химически инертен, при высоких – соединяется со многими элементами, проявляет сильные восстановительные свойства. Химическая активность разных форм углерода убывает в ряду: аморфный углерод, графит, алмаз. На воздухе они воспламеняются при температурах соответственно выше 300–500 °C, 600–700 °C и 850–1000 °C и сгорают с образованием оксида углерода и диоксида углерода. Помимо СO2 и СО, углерод образует неустойчивые С3O2 и С5O2. С водородом графит и аморфный углерод начинают реагировать при 1200 °C, с фтором – при 900 °C. Графит взаимодействует с фтором при 400–500 °C с образованием т. н. монофторида графита CFx (x = 0,68–0,99). Алмаз в атмосфере фтора сгорает при температуре выше 730 °C с образованием тетрафторида CF4. В атмосфере азота при пропускании электрического разряда между угольными электродами образуется циан. С серой графит даёт сероуглерод CS2, известны также CS и C3S2. С большинством металлов, бором и кремнием графит образует соответствующие карбиды, бориды, силициды. Графит растворяется в концентрированных растворах кислот-окислителей – серной и азотной. Алмаз инертен по отношению к кислотам и щелочам. Аморфный углерод (уголь) при нагревании выступает как активный восстановитель. Принципиальное отличие химии алмаза от химии графита состоит в том, что в результате химических взаимодействий кристаллическая решётка алмаза разрушается. Графит же в химических реакциях может сохранить свою слоистую структуру и образовать интеркалаты.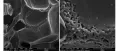 Структура сетчатого стеклоуглерода. Фото из сканирующего электронного микроскопа.
Из статьи: Yan D. [et al.]. The Study of High Strength Reticulated Vitreous Carbon Preparation Method // IOP Conference Series: Materials Science and Engineering. 2019. Vol. 678.
Структура сетчатого стеклоуглерода. Фото из сканирующего электронного микроскопа.
Из статьи: Yan D. [et al.]. The Study of High Strength Reticulated Vitreous Carbon Preparation Method // IOP Conference Series: Materials Science and Engineering. 2019. Vol. 678.
Применение
Углерод – один из важнейших источников энергии. Графит используется как замедлитель нейтронов в ядерных реакторах, восстановитель в металлургии, для получения электродов, лёгких термостойких углеродных материалов (углеграфитовые материалы, углепластики и др.), как твёрдая смазка. Исключительная твёрдость и высокий коэффициент преломления алмаза обусловливают его применение в режущих и абразивных материалах. Высоко ценятся гранёные и шлифованные кристаллы алмаза (бриллианты). Высокая теплопроводность алмаза (до 2000 Вт/м·К) делает его перспективным материалом для полупроводниковой техники. Карбин применяется в фотоэлементах. Сажа служит наполнителем в производстве резины, идёт на получение красок. Стеклоуглерод используется в атомной энергетике, служит для создания термостойких покрытий космических аппаратов и самолётов. В фармакологии и медицине широко используются различные формы углерода и его соединений – производные угольной кислоты и карбоновых кислот, различные гетероциклы, полимеры и другие соединения. Углеродные нанотрубки нашли применение для создания армированных термостойких прочных композиционных материалов, специальных бумаг, изготовления дисплеев.