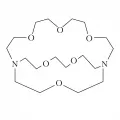
Криптанды
Крипта́нды, макрогетероциклические соединения, в состав которых входят два или более цикла, содержащих гетероатомы (О, N, S), соединённые между собой этиленовыми мостиками (например, формулы I–IV, R – органический заместитель). Рассматриваются как трёхмерные аналоги краун-эфиров. В молекулах криптандов имеются общие для нескольких циклов – узловые – атомы (С или N). Модифицирование боковых заместителей, изменение числа и типа гетероатомов в цикле или варьирование числа и размера циклов приводит к образованию большого числа разнообразных криптандов. Впервые синтезированы Ж.-М. Леном в 1968 г. За открытие и исследование свойств макрогетероциклических соединений Ж.-М. Лену, Ч. Педерсену, Д. Краму присуждена Нобелевская премия (1987).
Криптанды – жидкости или кристаллические вещества, растворимые в воде и органических растворителях. С катионами (щелочных, щёлочноземельных и некоторых других металлов), нейтральными молекулами (например, воды), анионами (Cl–, Br– и др.) образуют макроциклические комплексные соединения (криптаты), в которых «гость» расположен в трёхмерной внутримолекулярной полости криптанда и экранирован от взаимодействия с растворителем и противоионом. Своё название получили из-за способности сферически окружать ионы металлов (от греч. κρυπτός – скрытый). Щелочные металлы в присутствии криптандов растворяются в координирующих органических растворителях.
Криптанды с узловыми атомами N получают ацилированием азакраун-эфиров хлорангидридами дикарбоновых кислот с последующим восстановлением образующихся бициклических диамидов. Криптанды с узловыми атомами С синтезируют алкилированием гидроксиалкилкраун-эфиров дитозилатами полиэтиленгликолей. Криптанды – катализаторы и модификаторы различных химических реакций в органическом синтезе, высокоселективные сорбенты, экстрагенты для металлов, мембраноактивные соединения в ионоселективных электродах. Способность криптандов и краун-эфиров реализовывать комплексные взаимодействия типа «гость – хозяин» используется при изучении ассоциации химических структур за счёт невалентных взаимодействий – водородной, гипервалентной и топологической связей, электростатического и гидрофобного взаимодействий (см. в статье Супрамолекулярная химия).