Водород
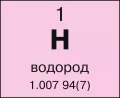
Водоро́д (лат. Hydrogenium), H, химический элемент VII группы короткой формы (1-й группы длинной формы) периодической системы; атомный номер 1, атомная масса 1,00794; неметалл. В природе два стабильных изотопа: протий 1H (99,985 % по массе) и дейтерий D, или 2H (0,015 %). Искусственно получаемый радиоактивный тритий T, или 3H (β-распад, период полураспада T1/2 12,33 года), в природе образуется в ничтожно малых количествах в верхних слоях атмосферы в результате взаимодействия космического излучения главным образом с ядрами азота N и кислорода O. Искусственно получены крайне неустойчивые радиоактивные изотопы 4H, 5H, 6H, 7H.
Историческая справка
 Женевьева Броссар де Больё. Портрет Антуана Лорана де Лавуазье. 1784.
Национальный музей Версаля и Трианонов.Впервые водород исследован в 1766 г. Г. Кавендишем и назван им «горючим воздухом». В 1787 г. А. Л. де Лавуазье показал, что этот газ при горении образует воду, включил его в список химических элементов и предложил название hydrogène (от греч. ὕδωρ – вода и γεννάω – рождать).
Женевьева Броссар де Больё. Портрет Антуана Лорана де Лавуазье. 1784.
Национальный музей Версаля и Трианонов.Впервые водород исследован в 1766 г. Г. Кавендишем и назван им «горючим воздухом». В 1787 г. А. Л. де Лавуазье показал, что этот газ при горении образует воду, включил его в список химических элементов и предложил название hydrogène (от греч. ὕδωρ – вода и γεννάω – рождать).
Распространённость в природе
Содержание водорода в атмосферном воздухе 3,5·10–6 % по массе, в земной коре 1 %. Главный резервуар водорода на Земле – вода (11,19 % водорода по массе). Водород относится к числу биогенных элементов, входит в состав соединений, образующих угли, нефть, природные горючие газы, многие минералы и др. В околоземном пространстве водород в виде потока протонов образует внутренний радиационный пояс Земли. Водород – самый распространённый элемент в космосе; в виде плазмы составляет около 70 % массы Солнца и звёзд, основная часть межзвёздной среды и газовых туманностей, присутствует в атмосфере ряда планет в форме H2, метана CH4, аммиака NH3, H2O и др.
Свойства
Конфигурация электронной оболочки атома водорода 1s1; в соединениях проявляет степени окисления 1 и –1. Электроотрицательность по Полингу 2,1; радиусы (пм): атомный 46, ковалентный 30, ван-дер-ваальсов 120; энергия ионизации H0→H+ 1312,0 кДж/моль. В свободном состоянии водород образует двухатомную молекулу H2, межъядерное расстояние 76 пм, энергия диссоциации 432,1 кДж/моль (0 K). В зависимости от взаимной ориентации ядерных спинов существуют орто-водород (параллельные спины) и пара-водород (антипараллельные спины), различающиеся по магнитным, оптическим и термическим свойствам и содержащиеся обычно в соотношении 3:1; при превращении пара-водорода в орто-водород затрачивается 1418 Дж/моль энергии.
Водород – газ без цвета, вкуса и запаха; tпл –259,19 °С, tкип –252,77 °С. Водород – самый лёгкий и наиболее теплопроводный из всех газов: при 273 К плотность 0,0899 кг/м3, теплопроводность 0,1815 Вт/(м·К). Не растворяется в воде; хорошо растворяется во многих металлах (лучше всего в Pd – до 850 % по объёму); диффундирует через многие материалы (например, сталь). На воздухе горит, образует взрывоопасные смеси. Твёрдый водород кристаллизуется в гексагональной решётке; при давлении свыше 104 МПа возможен фазовый переход с образованием структуры, построенной из атомов и обладающей металлическими свойствами, – т. н. металлический водород.
 Свечение водорода в газоразрядной трубке.Водород образует соединения со многими элементами. С кислородом образует воду (при температуре выше 550 °С реакция сопровождается взрывом), с азотом – аммиак, с галогенами – галогеноводороды, с металлами, интерметаллидами, а также со многими неметаллами (например, халькогенами) – гидриды, с углеродом – углеводороды. Практическое значение имеют реакции с оксидом углерода CO (смесь водорода и CO – синтез-газ). Водород восстанавливает оксиды и галогениды многих металлов до металлов, ненасыщенные углеводороды – до насыщенных (гидрирование). Ядро атома водорода – протон H+ – определяет кислотные свойства соединений. В водных растворах H+ образует с молекулой воды ион гидроксония H3O+. В составе молекул различных соединений водород склонен образовывать водородную связь со многими электроотрицательными элементами.
Свечение водорода в газоразрядной трубке.Водород образует соединения со многими элементами. С кислородом образует воду (при температуре выше 550 °С реакция сопровождается взрывом), с азотом – аммиак, с галогенами – галогеноводороды, с металлами, интерметаллидами, а также со многими неметаллами (например, халькогенами) – гидриды, с углеродом – углеводороды. Практическое значение имеют реакции с оксидом углерода CO (смесь водорода и CO – синтез-газ). Водород восстанавливает оксиды и галогениды многих металлов до металлов, ненасыщенные углеводороды – до насыщенных (гидрирование). Ядро атома водорода – протон H+ – определяет кислотные свойства соединений. В водных растворах H+ образует с молекулой воды ион гидроксония H3O+. В составе молекул различных соединений водород склонен образовывать водородную связь со многими электроотрицательными элементами.
Применение
Применяется в качестве носителя энергии. Газообразный водород используют в промышленном синтезе аммиака, соляной кислоты, метанола и высших спиртов, синтетического жидкого топлива и др., для гидрогенизации жиров и других органических соединений; в нефтепереработке – для гидроочистки и гидрокрекинга нефтяных фракций; в металлургии – для получения металлов (например, W, Mo, Re из их оксидов и фторидов), создания защитной среды при обработке металлов и сплавов; в производстве изделий из кварцевого стекла с использованием водородно-кислородного пламени, для атомно-водородной сварки тугоплавких сталей и сплавов и др.; как подъёмный газ аэростатов. Жидкий водород – горючее в ракетной и космической технике; применяется также в качестве хладагента.