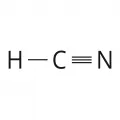Циановодород
Циановодоро́д (традиционное название – синильная кислота, устаревшее – цианистый водород), нитрил муравьиной кислоты, HCN.
Физико-химические свойства
Бесцветная легколетучая жидкость с характерным миндальным запахом, tкип 25,65 °C, tпл –13,29 °C; плотность 0,687 г/см3 (20 °C), хорошо растворяется в воде, этаноле, диэтиловом эфире; безводный HCN – сильно ионизирующий растворитель (при 25 °C диэлектрическая проницаемость 107). В водном растворе HCN очень слабая одноосновная циановодородная кислота (устаревшее название – цианистоводородная кислота), образующая с металлами соли – цианиды. Растворимые цианиды (соли щелочных и щёлочноземельных металлов) в водной среде сильно гидролизуются. Циановодород легко разлагается (особенно быстро на свету), продукты разложения – аммиак, муравьиная и щавелевая кислоты; вступает в реакции присоединения с HCl, H2S, SO2, при восстановлении водородом даёт метиламин CH3NH2, при полимеризации – нитрил аминомалоновой кислоты NC–CH(NH2)–CN, с альдегидами и кетонами образует нитрилы.
Нахождение в природе
Циановодород встречается в растениях в свободном и связанном виде (гликозиды, например амигдалин).
Получение
В промышленности получают окислением смеси NH3 и CH4 на платиновом катализаторе.
Применение
Применяют для синтеза цианидов, хлорциана, динитрила адипиновой кислоты, акрилонитрила и др., в производстве пестицидов.
Циановодород и цианиды высокотоксичны. Во время Первой мировой войны 1914–1918 гг. синильная кислота использовалась как боевое отравляющее вещество. Симптомы острого отравления: при больших дозах человек теряет сознание, затем наступает паралич дыхания и остановка сердца. Механизм действия: HCN взаимодействует в организме с железом цитохромоксидазы, блокируя процесс биологического окисления во всех органах и тканях организма.