Стереоселективность
Стереоселекти́вность (от стерео… и лат. selectio – выбор, отбор), способность в химической реакции образования двух и более стереоизомерных продуктов в соотношении, отличающемся от статистического, с преимущественным образованием одного из них. Стереоселективность является одной из разновидностей продуктоселективности реакции (другая разновидность – региоселективность). Стереоселективность изучается в разделе динамической стереохимии.
Стереоселективность зависит от двух факторов. Во-первых, от стереоэлектронных эффектов, предполагающих выполнение требований принципа минимальных структурных изменений Хайна: предпочтительно протекает та реакция, которая требует наименьших изменений положений атомов в пространстве и электронных конфигураций. Последнее условие означает экстремальное (максимально или минимально благоприятное) перекрывание орбиталей взаимодействующих молекул или фрагментов одной молекулы, что в случае перициклических реакций совпадает с принципом сохранения орбитальной симметрии (см. в статье Правила Вудворда – Хофмана).
Во-вторых, стереоселективность зависит от стерических (пространственных) эффектов – от наличия или отсутствия стерических препятствий вблизи реакционных центров. Например, реакции гидрирования (рис. 1, а) и восстановления карбонильной группы (рис. 1, б) регулируются метильным заместителем в кольце. В обоих примерах реагентам (соответственно H2 и H−) стерически легче подойти к субстратам со стороны, противоположной имеющейся метильной группе, что, в свою очередь, вызывает отгибание новой одинарной С−С-связи (рис. 1, а) или связи C−O (рис. 1, б) в ту же сторону, что и метил. Эти эффекты и объясняют экспериментально наблюдающиеся соотношения стереоизомеров.
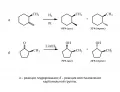 Рис. 1. Соотношения стереоизомерных продуктов.
Рис. 1. Соотношения стереоизомерных продуктов.
Эпоксидирование симметричного алкена типа бутена-2 мета-хлорнадбензойной кислотой (mCPBA) (рис. 2, а) или гидратация фумаровой кислоты (рис. 2, б) не являются стереоселективными процессами, приводя к образованию рацемических смесей с соотношением продуктов 1:1. В то же время каталитическая гидратация фумаровой кислоты в присутствии фермента фумаразы протекает со стереоселективностью 100 % (рис. 2, в).
 Рис. 2.
Рис. 2.
Когда в результате реакции образуются энантиомеры, стереоселективную реакцию называют энантиоселективной, а когда образуются диастереомеры – диастереоселективной реакцией. Иногда в стереоселективном процессе не удаётся обнаружить аналитическими методами минорные продукты из-за их предельно низкой концентрации.
Количественно стереоселективность характеризуется величиной энантиомерного или диастереомерного избытка – соответственно enantiomeric/diastereomeric excess (ee/de). В случае образования двух продуктов:
где , – количества энантиомерных продуктов реакции.
Объяснение стереоселективности основано на теории переходного состояния: предпочтительное образование одного из изомерных продуктов связано с меньшей энергией активации на данном реакционном пути (рис. 3).
 Рис. 3.Диастереомерные продукты образуются из диастереомерных переходных состояний, различных по энергии. Соотношение продуктов контролируется либо кинетически (разные величины энергетических барьеров и, следовательно, разные скорости образования продуктов), либо термодинамически (при разных свободных энергиях диастереомеров), либо и тем и другим одновременно.
Рис. 3.Диастереомерные продукты образуются из диастереомерных переходных состояний, различных по энергии. Соотношение продуктов контролируется либо кинетически (разные величины энергетических барьеров и, следовательно, разные скорости образования продуктов), либо термодинамически (при разных свободных энергиях диастереомеров), либо и тем и другим одновременно.
Следует также отметить, что ни одна химическая реакция не является в чистом виде энантиоселективной.
Для искусственного создания энантиоселективности используются такие технологии, как хиральный катализ, фотосенсибилизация, хиральные вспомогательные реагенты, хиральные растворители, электрохимический (электродный) стереоконтроль и т. д. Например, в адсорбированной на аноде литиевой соли непредельного амина происходит одноэлектронный перенос, и образующийся аминильный радикал циклизуется (рис. 4), создавая при кинетическом контроле только цис-продукт, хотя и менее стабильный термодинамически. В то же время при химическом окислении исходного амина дихлоридом ртути селективность процесса снижается: в этом случае при термодинамическом контроле образуется 35 % энергетически более устойчивой транс-формы и 17 % цис-формы.
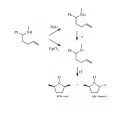 Рис. 4. Анодный стереоконтроль реакции циклизации непредельного амина.
Рис. 4. Анодный стереоконтроль реакции циклизации непредельного амина.
Как отмечалось ранее, разнообразные примеры стереоселективности можно обнаружить в перициклических реакциях. Например, реакция Дильса – Альдера между малеиновым ангидридом и циклопентадиеном приводит главным образом к образованию эндо-аддукта. При этом экзо-аддукт, несмотря на большую термодинамическую стабильность, получается в меньшем количестве (рис. 5, а). В конкурирующих переходных состояниях экзо- и эндо-циклоприсоединения энергетическая предпочтительность эндо-пути обусловлена т. н. вторичными орбитальными взаимодействиями реагентов (эндо-правило Альдера, рис. 5, б). На рис. 3 конкурирующим путям процесса отвечают кривые 1 (эндо-путь) и 2 (экзо-путь) соответственно.
 Рис. 5.
Рис. 5.
Примером стереоселективности является эпоксидирование с участием хирального катализатора по Шарплессу. При окислении аллиловых спиртов трет-бутилгидропероксидом в присутствии катализатора – комплекса тетра(изопропоксида) титана с хиральным лигандом – энантиомерные продукты (оптически активные эпоксидные спирты) образуются в неравных количествах. В качестве хирального лиганда используется диэтиловый эфир винной кислоты (диэтилтартрат, DET). В зависимости от конфигурации лиганда (+) DET / (−) DET эпоксидирование проходит избирательно для разных сторон от плоскости двойной связи (рис. 6).
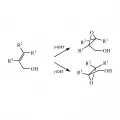 Рис. 6. Стереоселективное эпоксидирование по Шарплессу.
Рис. 6. Стереоселективное эпоксидирование по Шарплессу.
Стереоселективно протекает и асимметричное дигидроксилирование по Шарплессу – взаимодействие алкена с тетраоксидом осмия OsO4 в присутствии хиральных лигандов хинина (AD-mix-α или AD-mix-β). Приготовленные по специальной методике, последние позволяют окислять алкены до диолов стереоселективно, с одной стороны от плоскости двойной связи алкена. Диастереоселективность такого процесса зависит от выбора хирального лиганда (AD-mix-α/AD-mix-β) и от строения алкена. Постадийный механизм каталитического процесса сводится к 3+2-циклоприсоединению тетраосмийлигандного комплекса к двойной связи алкенового субстрата (рис. 7).
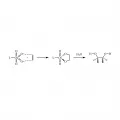 Рис. 7. Механизм каталитического асимметричного дигидроксилирования по Шарплессу.В реакции на рис. 8 энантиомерный избыток ee ~99 %.
Рис. 7. Механизм каталитического асимметричного дигидроксилирования по Шарплессу.В реакции на рис. 8 энантиомерный избыток ee ~99 %.
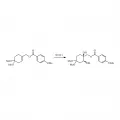 Рис. 8. Асимметричное дигидроксилирование аллильного производного 4-метоксибензоата.Известным примером умеренной стереоселективности является дегидрогалогенирование 2-иодбутана с неравными выходами геометрически изомерных алкенов (рис. 9).
Рис. 8. Асимметричное дигидроксилирование аллильного производного 4-метоксибензоата.Известным примером умеренной стереоселективности является дегидрогалогенирование 2-иодбутана с неравными выходами геометрически изомерных алкенов (рис. 9).
 Рис. 9. Дегидрогалогенирование 2-иодбутана.
Рис. 9. Дегидрогалогенирование 2-иодбутана.
Такая реакция является диастереоселективной.
Умеренно стереоселективно протекает и дегидратация спиртов (рис. 10).
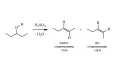 Рис. 10. Дегидратация спиртов.
Рис. 10. Дегидратация спиртов.
Стереоизомеры часто проявляют различную биологическую активность.
Понятия «стереоселективность» и «стереоспецифичность» связаны друг с другом: все стереоспецифические реакции стереоселективны.
