Терпены
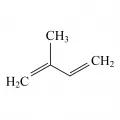
Терпе́ны, класс природных соединений, имеющих химическую формулу (C5H8)n, где n > 1. Представляют собой углеводороды, чаще всего непредельные, – олигомеры и полимеры изопрена (2‑метил‑1,3‑бутадиена). В зависимости от количества изопреновых звеньев различают монотерпены (n = 2), сесквитерпены (n = 3), дитерпены (n = 4) и т. д. Также всё большее прикладное значение в 21 в. получают природные полимеры, такие как природный каучук, используемые при получении резин и других латексных изделий, и гуттаперча, которая используется в стоматологии при пломбировании.
Термин «терпены» применяют к углеводородам соответствующей структуры и состава, тогда как к их производным, содержащим атомы кислорода или другие гетероатомы, − терпеноиды или изопреноиды. В научной и научно-популярной литературе эти два термина часто взаимозаменяемы. К терпеноидам относят не только вещества, в состав которых включены новые атомы, но и соединения, содержащие укороченные терпеновые фрагменты, такие как стероиды, в том числе стероидные гормоны, фитогормоны гиббериллины и др. Для терпеноидов классификация становится максимально расплывчатой и не основывается на структурном принципе, а происходит из биосинтеза.
Историческая справка
Понятие «терпены» было введено в 1866 г. немецким химиком Ф. А. Кекуле для обозначения изомерных соединений формулы C10H16, выделяемых из скипидарного (нем. terpentin) масла (Kekulé F. A. Lehrbuch der organischen Chemie oder. Bd. 2. Erlangen, 1866. S. 464). В дальнейшем термин был распространён на другие соединения растительного происхождения с большим числом атомов. Особо крупный вклад в области изучения терпенов принадлежит швейцарскому химику Л. Ружичке, посвятившему этому практически всю свою научную карьеру. В 1953 г. Ружичкой было сформулировано «биогенетическое изопреновое правило» (углеродный скелет терпеноидов состоит из регулярно или нерегулярно соединённых изопреновых звеньев) (Ruzicka L. The Isoprene Rule and the Biogenesis of Terpenic Compounds // Experientia. 1953. Vol. 9, fasc. 10. P. 357–367). В 1939 г. ему была присуждена Нобелевская премия по химии «за его работу по полиметиленам и высшим терпенам» (The Nobel Prize in Chemistry 1939 // The Nobel Prize). В 1952 г. под его руководством был выделен ланостерол, позволивший показать прямую связь между терпенами и стероидами.
Получение и нахождение в природе
Основным природным источником терпенов и терпеноидов являются растения, в особенности хвойные. Например, из живицы (смолы) при перегонке с водяным паром получают скипидар – жидкую смесь терпенов и терпеноидов (преимущественно моно- и сескви-, основной компонент – изомерные пинены), в то время как нелетучий остаток после этого процесса получил название канифоль и представляет собой смесь, в основном дитерпеноидных производных. Многие другие эфирные масла являются основным промышленным источником терпенов и терпеноидов, в особенности эфирные масла хвойных, рутовых (цитрусовых), яснотковых (мята, шалфей, базилик и т. д.) и некоторые другие.
Тем не менее не все эфирные масла содержат терпены в значительных количествах – например, анисовое эфирное масло состоит на 90 % из фенилпропаноидов анетола и метилхавикола.
Промышленное значение терпенов достаточно велико. Скипидар используется в качестве растворителя лаков и красок. Различные компоненты эфирных масел используются в парфюмерии. Также терпены находят применение в медицине, пищевой и фармацевтической химии, производстве полимеров. Перспективным направлением является использование терпенов в качестве компонентов биотоплив.
Классификация терпенов
С точки зрения химической структуры терпены отличаются огромным разнообразием, а также наличием большого числа изомеров, включая изомерию кратных связей.
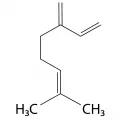
Так, к примеру, ациклические монотерпены β‑мирцен, β‑(E)‑оцимен являются региоизомерами, различающимися положением одной из кратных связей. У β-(E)-оцимена имеется также стереоизомер с Z‑конфигурацией одной из двойных связей в диеновой системе. Для циклических и полициклических терпенов, в свою очередь, появляется возможность наличия энантиомеров. (R)‑ и (S)‑Лимонены имеют различные запахи – цитрусовый для (R)-изомера и хвойный для (S)‑изомера. Бициклические пинены являются наиболее доступными терпенами и составляют до 80 % скипидарного масла. Интересно, что (1S)‑(−)‑α‑пинен распространён в соснах, произрастающих в Евразии, в то время как (1R)‑(+)‑α‑изомер – в Северной Америке.
Структурное разнообразие растёт с увеличением числа изопреновых звеньев. В частности, в моноциклических сесквитерпенах наблюдаются следующие размеры циклов: 6-членный в бисаболенах, 10‑членный в гермакренах, 11‑членный в гумулене.
Для дитерпенов количество возможных структурных мотивов ещё выше, однако в основном они представлены в окисленных производных – терпеноидах.
Схематичное структурное разнообразие терпенов
Число циклов | |||||
0 (алифатические терпены) | 1 (моноциклические) | 2 (бициклические) | 3 (трициклические) | 4 (тетрациклические) | |
Монотерпены С10H16 | пинен, камфен, сабинен | трициклен | |||
Сесквитерпены C15H24 | фарнезен | бисаболен, гумулен, гермакрен | кадинен, кариофиллен
| копаен, иланген | лонгициклен, циклосативен |
Дитерпены C20H32 | (фитан) | цембрен А | скларен, (лабдан) | абитадиен, таксадиен | стемарен, стемоден, каурен |
Структурное разнообразие терпенов на избранных примерах
Важным представителем тритерпенов является сквален (C30H50), который способен циклизоваться под действием ферментов в ланостерол – предшественник природных стероидов грибов и животных. Высшие терпены, такие как фитоен (C40H64), играют ключевую роль в биосинтезе каротиноидов – провитаминов группы А.
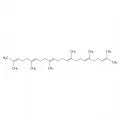
Полимерные терпены представлены натуральным каучуком – стереорегулярным полимером изопрена, содержащим цис-двойные связи, и гуттаперчей – полимером с транс-двойными связями.
Биосинтез
Представления о биосинтезе терпенов развивались с 1953 г., когда Л. Ружичка сформулировал «изопреновое правило». Как было показано с помощью экспериментов с использованием изотопных меток, в образовании терпенов участвуют соединения, содержащие фрагмент из пяти атомов углерода. Основным строительным блоком С5 является не изопрен, а два изомерных пирофосфата: диметилаллил пирофосфат (ДМАПФ) и изопентенил пирофосфат (ИППФ), находящихся обычно в соотношении 1:5 – 1:4. Эти два соединения могут образовываться из мевалоновой кислоты в результате серии ферментативных реакций. Изначально считалось, что мевалонатный путь биосинтеза терпенов (изопреноидов) является универсальным для всех живых организмов, однако в 1980-е гг. было обнаружено, что для многих растений, большинства бактерий и некоторых простейших существует альтернативный способ биосинтеза ДМАПФ и ИППФ – метилэритролфосфатный путь (немевалонатный путь) биосинтеза.
Под действием фермента геранил пирофосфат синтазы ДМАПФ и ИППФ сочетаются между собой с образованием геранил пирофосфата – первого общего предшественника всех терпенов и терпеноидов. Дальнейшие ферментативные превращения крайне разнообразны и во многом характеризуются химией карбокатионов, возникающих после отщепления пирофосфат-аниона.
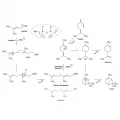 Упрощённая биосинтетическая схема образования монотерпенов.В случае гидролиза образующегося карбокатиона на одной из стадий образуются терпеноиды, например гераниол. В отсутствие гидролиза возможен как выброс протона, что приводит к образованию ациклических монотерпенов (например, мирцена), так и циклизация с последующим выбросом протона, ведущая к циклическим терпенам, таким как лимонен, пинен. Участие в реакциях карбокатионов, возможность карбокатионных перегруппировок, различные роли ферментов, катализирующих реакции, – всё это определяет химическое многообразие терпенов. За счёт включения гетероатомов разнообразие терпеноидов ещё больше, в настоящий момент известно более 80 тыс. производных.
Упрощённая биосинтетическая схема образования монотерпенов.В случае гидролиза образующегося карбокатиона на одной из стадий образуются терпеноиды, например гераниол. В отсутствие гидролиза возможен как выброс протона, что приводит к образованию ациклических монотерпенов (например, мирцена), так и циклизация с последующим выбросом протона, ведущая к циклическим терпенам, таким как лимонен, пинен. Участие в реакциях карбокатионов, возможность карбокатионных перегруппировок, различные роли ферментов, катализирующих реакции, – всё это определяет химическое многообразие терпенов. За счёт включения гетероатомов разнообразие терпеноидов ещё больше, в настоящий момент известно более 80 тыс. производных.