Углеводороды
Углеводоро́ды, класс органических соединений, включающих в свой состав только атомы углерода и водорода. Углеводороды образуют гомологические ряды, характеризующиеся закономерным изменением физических и химических свойств.
Классификация
По типу химической связи между атомами углерода различают насыщенные углеводороды состава CnH2n+2, в которых C-атомы соединены простой связью, и углеводороды, содержащие одну или несколько кратных связей (ненасыщенные углеводороды). Ненасыщенные углеводороды с одной двойной связью состава CnH2n называют олефинами, или алкенами, с двумя двойными связями состава CnH2n−2 – диолефиновыми углеводородами, или диенами, с одной тройной связью состава CnH2n−2 – ацетиленовыми углеводородами, или алкинами. По типу строения углеводороды подразделяются на алифатические (ациклические), молекулы которых представляют собой линейные или разветвлённые открытые цепи атомов углерода (алканы, алкены и алкины), и циклические углеводороды, молекулы которых представляют собой циклы из трёх и более атомов углерода. Циклические углеводороды включают в себя алициклические (циклоалканы, или нафтены, циклоалкены) и ароматические углеводороды, содержащие в составе особую циклическую группировку из шести атомов углерода, которые соединены между собой последовательно чередующимися простыми и двойными связями (бензольное ядро).
Номенклатура
В гомологическом ряду алканов первые четыре соединения имеют исторически сложившиеся названия (метан, этан, пропан и бутан); начиная с пятого углеводорода в основе названия лежит греческое числительное, равное числу атомов углерода в молекуле. В соответствии с номенклатурой ИЮПАК названия насыщенных углеводородов имеют суффикс -ан, например пентан и т. д. В ряду алкенов названия образуются от соответствующих алканов при изменении суффикса -ан на -ен, таким образом, от этана производят этен, от пентана – пентен и т. д.; часто применяют суффикс -илен, например этилен, пропилен, амилен (вместо пентена). Аналогично для алкинов названия производят, изменяя суффикс в названии соответствующего алкана на -ин. Простейший член этого ряда называется этин, однако чаще используют тривиальное название «ацетилен».
Изомерия углеводородов
Алканы с числом C-атомов больше трёх, алкены и алкины с числом C-атомов пять и более имеют изомерные соединения, обусловленные простейшим видом структурной изомерии углеродного скелета. По мере увеличения числа атомов углерода в молекуле число изомеров возрастает с огромной скоростью. Например, гексан имеет пять изомеров:
H3C−CH2−CH2−CH2−CH2−CH3 (н-гексан);
CH3−CH(CH3)−CH2−CH2−CH3 (2-метилпентан);
CH3CH2−CH(CH3)−CH2−CH3 (3-метилпентан);
CH3−C(CH3)2−CH2−CH3 (2,2-диметилбутан);
CH3−CH(CH3)−CH(CH3)−CH3 (2,3-диметилбутан).
Название изомеров образовывают, выделяя наиболее длинную цепь C-атомов и нумеруя эти атомы от того, к которому ближе разветвление. Если заместителей несколько и они равноудалены от концов главной цепи, нумерацию начинают от того края, где находится простейший заместитель. В названии углеводородов цифрой указывают, при каком атоме углерода находится заместитель, и называют его, начиная с простейшего. Если заместители одинаковые, то номер повторяют, а перед названием заместителя ставят приставку от греческого числительного («ди» – 2, «три» – 3, «тетра» – 4 и т. д.), например 2,2-диметилбутан.
Изомерия нафтеновых углеводородов обусловлена как изменением размера углеродного скелета (например, циклогексан и метилциклопентан, или 2-метил-3-этилциклопентан и 2,3-диметилциклогексан), так и положением двух и более заместителей в кольце (2,2-, 2,3- и 2,4-диметилциклогексан и т. д.).
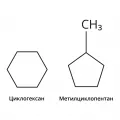 Структурные формулы циклогексана и метилциклопентана.Для алкенов и алкинов у соединений с числом C-атомов четыре и более существует изомерия по положению кратной связи в молекуле, которое обозначают наименьшей цифрой, соответствующей атому углерода при кратной связи, например: CH2=CH−CH2−CH3 (бутен-1) и CH3−CH=CH−CH3 (бутен-2).
Структурные формулы циклогексана и метилциклопентана.Для алкенов и алкинов у соединений с числом C-атомов четыре и более существует изомерия по положению кратной связи в молекуле, которое обозначают наименьшей цифрой, соответствующей атому углерода при кратной связи, например: CH2=CH−CH2−CH3 (бутен-1) и CH3−CH=CH−CH3 (бутен-2).
Для дизамещённых алкенов характерна стереоизомерия, связанная с различным положением заместителей на плоскости у двойной связи и обусловленная невозможностью их свободного вращения вокруг неё.
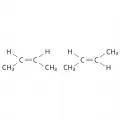 Структурные формулы цис-бутена-2 и транс-бутена-2.Для ароматических углеводородов характерна изомерия положения заместителей в молекуле бензола, где заместители у соседних атомов углерода имеют название орто-, через один C-атом – мета-, напротив – пара-.
Структурные формулы цис-бутена-2 и транс-бутена-2.Для ароматических углеводородов характерна изомерия положения заместителей в молекуле бензола, где заместители у соседних атомов углерода имеют название орто-, через один C-атом – мета-, напротив – пара-.
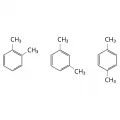 Структурные формулы орто-, мета- и пара-ксилолов.
Структурные формулы орто-, мета- и пара-ксилолов.
Строение углеводородов
Строение алканов или нафтенов обусловлено тем, что атомы углерода в них находятся в состоянии sp3-гибридизации, т. е. в образовании связи между атомами углерода участвуют одна s-орбиталь и три p-орбитали. В молекуле метана все четыре связи C−H являются одинарными, они образуются путём перекрывания sp3-орбиталей углерода и s-орбитали каждого водорода и называются δ-связями (сигма-связь). Оси этих гибридных sp3-орбиталей направлены к вершинам правильного тетраэдра, угол между ними равен 109°28′, длина C−C-связи составляет 0,154 нм, длина C−H-связи равна 0,110 нм.
В алкенах атомы углерода при двойной связи находятся в состоянии sp2-гибридизации, где при смешении одной s-орбитали и двух p-орбиталей образуются три одинаковые гибридные орбитали, расположенные относительно друг друга под валентным углом 120°. Атом углерода в состоянии sp2-гибридизации образует три δ-связи и одну π-связь (пи-связь), перпендикулярную плоскости δ-связей. Длина C=C-связи в алкенах равна 0,134 нм.
В алкинах атомы углерода находятся в состоянии sp-гибридизации, каждый C-атом обладает двумя гибридными sp-орбиталями, оси которых расположены на одной линии под углом 180° друг к другу, а две негибридных p-орбитали находятся под углом 90° по отношению друг к другу и к sp-гибридным орбиталям. Тройная связь является сочетанием одной δ-связи и двух π-связей. Длина тройной связи составляет 0,120 нм.
Физические свойства
Углеводороды (алканы) с числом C-атомов от 1 до 4 – газы без цвета и запаха, от 5 до 16 включительно – жидкости с запахом бензина, выше – твёрдые вещества белого цвета, жирные на ощупь. Температуры кипения и плавления, а также плотность увеличиваются с ростом числа C-атомов. Разветвлённые парафины, а также нафтены и ароматические углеводороды с алкильными группами имеют температуры кипения и плавления ниже, чем соединения нормального строения. Температуры кипения циклоалканов выше, чем у соответствующих алканов.
Алканы практически нерастворимы в воде, но хорошо растворяются в неполярных органических растворителях. Жидкие и твёрдые алканы смешиваются друг с другом. Газообразные и жидкие алканы образуют с воздухом взрывоопасные смеси. Все углеводороды, особенно парафины, являются хорошими изоляторами (диэлектрическая проницаемость равна 2–3).
Химические свойства
Алканы устойчивы к действию обычных окислителей (перманганат калия, бромная вода и т. п.). Алканы горят с образованием диоксида углерода и воды; высокая теплота процесса обеспечивает их использование в качестве топлив. При каталитической обработке кислородом в мягких условиях протекает реакция окисления, которая является многостадийным процессом.
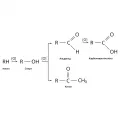 Окисление алканов.При нагревании углеводородов до температуры 470–550 °C происходит их термическое разложение (крекинг), которое заключается в расщеплении связей C−C и образовании насыщенных и ненасыщенных углеводородов с более короткими цепями. Пропускание алканов над катализаторами (Ni, Pt, Al2O3, Cr2O3) и нагревание до 400–600 °C приводят к отщеплению атомов водорода и образованию ненасыщенных углеводородов (реакция дегидрирования). При контакте алканов с числом C-атомов шесть и более с катализаторами Cr2O3 (500 °C) или Pt (300 °C) протекает реакция дегидроциклизации (ароматизации) с образованием производных бензола. Под действием катализаторов (например, хлорид алюминия AlCl3) н-парафины и нафтены подвергаются реакции изомеризации. Так, н-бутан превращается в изобутан, а циклогексан – в метилциклопентан.
Окисление алканов.При нагревании углеводородов до температуры 470–550 °C происходит их термическое разложение (крекинг), которое заключается в расщеплении связей C−C и образовании насыщенных и ненасыщенных углеводородов с более короткими цепями. Пропускание алканов над катализаторами (Ni, Pt, Al2O3, Cr2O3) и нагревание до 400–600 °C приводят к отщеплению атомов водорода и образованию ненасыщенных углеводородов (реакция дегидрирования). При контакте алканов с числом C-атомов шесть и более с катализаторами Cr2O3 (500 °C) или Pt (300 °C) протекает реакция дегидроциклизации (ароматизации) с образованием производных бензола. Под действием катализаторов (например, хлорид алюминия AlCl3) н-парафины и нафтены подвергаются реакции изомеризации. Так, н-бутан превращается в изобутан, а циклогексан – в метилциклопентан.
Основным типом реакций для предельных углеводородов является замещение атомов водорода в их молекуле, например в реакциях галогенирования (реагенты – хлор или бром), нитрования смесью HNO3 с H2SO4 при 140 °C (реакция Коновалова) или сульфохлорирования смесью газов SO2 и Cl2 (реакция Рида). Циклогексан и его гомологи легко дегидрируются на катализаторах Pt, Pd, Ni при 250–320 °C с образованием ароматических углеводородов (реакция Зелинского).
Для ненасыщенных углеводородов (олефины, диены, ацетилены) характерны реакции присоединения по кратным связям галогенов, кислот, озона и др. Они легко подвергаются термической и каталитической олиго- и полимеризации. Олефины могут присоединяться к разветвлённым парафинам и к ароматическим углеводородам под действием AlCl3 или сильных кислот – H2SO4, HF (реакция алкилирования).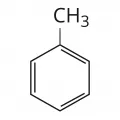 Структурная формула толуола.
Структурная формула толуола.
Для ароматических углеводородов типичны реакции замещения атомов водорода при нитровании или сульфировании; галогенирование в зависимости от условий может приводить к реакциям как замещения, так и присоединения. Ароматические углеводороды каталитически (Pt, Pd, Ni) гидрируются в нафтены при повышенных температуре и давлении; взаимодействуют с галогенпроизводными в присутствии кислотных катализаторов, например AlCl3, BF3 и др. (реакция Фриделя – Крафтса). Так, бензол с метилхлоридом образует толуол C6H5CH3, а с ацетилхлоридом – ацетофенон C6H5COCH3.
Нахождение в природе
Главным природным ресурсом углеводородов является нефть, содержащая практически все основные классы этих соединений. Состав, строение и свойства углеводородов нефти определяются условиями залегания месторождений (температура, давление, возраст и природа окружающих пород). Источником низших алканов, в основном метана, является природный газ и попутные газы нефтедобычи. Большие запасы метана сосредоточены в виде газогидратов, представляющих собой кристаллические комплексные соединения нестехиометрического состава из метана и воды. Такие комплексы (клатраты) образуются при определённых давлении и температуре (как правило, около 0 °C) вблизи дна океанов и морей. По различным оценкам, запасы углеводородов в гидратах составляют 1,8·1014–7,6·1018 м3.
Методы получения
К методам получения алканов, не сопровождающегося изменением числа C-атомов в молекуле, относятся гидрирование непредельных углеводородов под влиянием металлов платиновой группы, восстановление галогенпроизводных, спиртов и карбонильных соединений (реакции Кижнера – Вольфа и Клемменсена).
Методы синтеза с увеличением числа C-атомов включают взаимодействие алкилгалогенидов с натрием Na (реакция Вюрца) и каталитический (Fe, Co, Ru) синтез из CO и H2 (синтез Фишера – Тропша). К получению алканов с меньшим числом C-атомов приводят методы крекинга углеводородов.
Циклоалканы получают реакцией дигалогензамещённых алканов, например CH2Br−CH2−CH2−CH2Br с Na или цинковой пылью. Другой метод заключается в гидрировании бензола и его производных.
К методам получения алкенов относятся:
дегидратация спиртов при нагревании в присутствии кислот;
расщепление алкилгалогенидов под действием концентрированных щелочей;
отщепление двух атомов галогена от дигалогеналканов в присутствии металлов (Zn, Mg);
каталитическая дегидрогенизация алканов (400–600 °C, Cr2O3 и др.);
крекинг и пиролиз высших углеводородов;
селективное гидрирование алкинов.
Получение диена с кумулированными двойными связями, аллена (CH2=C=CH2), проводят в 2 стадии из 1,2,3-трибромпропана (CH2Br−CHBr−CH2Br) нагреванием с KOH с образованием CH2=CBr−CH2Br и дебромированием под действием цинковой пыли. Простейший сопряжённый диен, бутадиен (CH2=CH−CH=CH2), получают конденсацией альдегида и спирта под действием глинозёма (реакция Остромысленского), каталитическим процессом дегидратации и дегидрирования этанола при 400–500 °C (реакция Лебедева), дегидрированием фракции C4 природного или попутного газов при 500–650 °C над алюмо-хромовым катализатором или пиролизом ацетилена, этилена либо их смеси. Синтез изопрена (CH2=C(CH3)−CH=CH2) основан на дегидрировании изопентана при нагревании над Cr2O3 или на дегидрогалогенировании 1,3-дибром-2-метилбутана (CH2Br−C(CH3)−CHBr−CH3) под действием NaOH.
К методам получения ароматических углеводородов относятся:
тримеризация ацетилена в бензол над активированным углем при 650 °C;
дегидрирование циклоалканов под действием металлов платиновой группы при 250–320 °C (получение бензола и его производных);
дегидроциклизация алканов C6 и более в углеводороды ряда бензола.
Применение
Газообразные и жидкие алканы используют в качестве топлива, в том числе для двигателей; высшие парафины и нафтены – для производства смазочных материалов; олефиновые, диеновые и ацетиленовые углеводороды – при получении полимерной продукции; ароматические углеводороды – в производстве лекарственных препаратов, красителей, взрывчатых веществ. Кроме этого, углеводороды всех классов используют как сырьё в химической промышленности и в качестве растворителей.