Хлорофиллы
Хлорофи́ллы (от греч. χλωρός – зелёный и φύλλον – лист), универсальные зелёные пигменты фотосинтезирующих растений, водорослей и бактерий, которые отсутствуют у паразитических растений (повилика, заразиха). Аналоги хлорофиллов – бактериохлорофиллы, обнаружены у фототрофных бактерий, осуществляющих фотосинтез без выделения кислорода.
Термин «хлорофилл» впервые предложен французскими химиками П. Ж. Пельтье и Ж. Б. Каванту в 1817 г. Значительное влияние на изучение роли хлорофилла в использовании растениями энергии солнечного света оказали труды К. А. Тимирязева. Во 2-й половине 20 в. огромный вклад в исследование фотохимии хлорофилла и его участия в окислительно-восстановительных процессах в цепи переноса электронов при фотосинтезе внёс российский учёный, биохимик и биофизик А. А. Красновский. Изучение свойств хлорофиллов и синтез новых форм этих соединений активно продолжается и поныне.
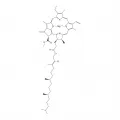
Строение хлорофиллов
В молекуле хлорофилла выделяют 2 части: гидрофильную, образованную порфириновым ядром или магний-порфириновым кольцом, и гидрофобную, представленную фитолом (высокомолекулярный спирт, Phy). Порфириновое ядро имеет площадь 1 нм и состоит из центрального атома магния (Mg), соединённого с 4 атомами азота (N) пиррольных колец (I, II, III, IV). При этом магний с 2 атомами азота образует ковалентную связь, а с 2 другими – координационную (донорно-акцепторную). Пиррольные кольца связаны между собой метиновыми мостиками (=СН-), образуя тетрапиррольное кольцо. К пиррольному кольцу III прикреплено циклопентановое кольцо (V) с химически активной карбоксильной группой, соединённой сложноэфирной связью с метиловым спиртом. Порфириновое ядро и циклопентановое кольцо образуют структуру, именуемую форбин. В пиррольном кольце IV имеется сложноэфирная связь с фитолом (C20H39OH), который образует углеводородную цепь с одной двойной связью длиной 2 нм, из-за чего эту часть молекулы хлорофилла часто называют фитольным или изопреноидным хвостом. Имеется также ряд заместителей по всем 4 пиррольным кольцам.
Тетрапиррольное кольцо хлорофиллов на протяжении эволюции почти не изменилось. По своему строению молекула хлорофилла близка к базовой структуре гемов – природных комплексов порфиринов, содержащих железо (гемоглобин, миоглобин, цитохромы), и простетическим группам ферментов пероксидаз и каталазы.
Химические свойства
Xлорофиллы – высокоплавкие интенсивно окрашенные кристаллы от зелёного до тёмно-красного и чёрного цветов. По химической природе хлорофиллы – сложные эфиры дикарбоновой хлорофиллиновой кислоты и 2 остатков спиртов – метанола и фитола. Наличие подвижных электронов, окружающих тетрапиррольное кольцо, делает хлорофиллы нестабильными в присутствии ферментов. Кроме того, хлорофиллы разрушаются при действии света, кислот, щёлочи, высокой температуры и кислорода. Хлорофиллы не растворяются в воде, но хорошо растворяются в органических растворителях (этанол, ацетон, бензол, серный эфир и др.). При взаимодействии со щёлочью происходит реакция омыления хлорофилла, при этом образуются метанол, фитол и натриевая соль хлорофиллиновой кислоты (хлорофиллин). При действии кислоты на хлорофилл происходит замещение магния двумя протонами водорода, в результате образуется феофитин – вещество красно-бурого цвета.
В природе феофитин образуется при действии на растения абиотических стрессовых факторов (например, низкой температуры) и старении листьев. В этих случаях нарушается избирательная проницаемость мембран и кислый клеточный сок, содержащий органические кислоты, проникает в хлоропласт и взаимодействует с хлорофиллом.
Способность молекулы хлорофилла к обратимым окислительно-восстановительным реакциям (отдавать и принимать электроны) под действием света обусловлена наличием в её структуре атома азота с неподелёнными электронами и системы сопряжённых связей, образованной делокализованными (подвижными) p-электронами. Например, тетрапиррольное кольцо хлорофилла a содержит 10 сопряжённых двойных связей. В молекуле хлорофилла именно атом азота может отдавать электрон (окисляться) или присоединять его (восстанавливаться), тогда как с помощью атома магния пиррольные кольца располагаются в одной плоскости, обеспечивая взаимодействие p-электронных облаков. Кроме того, магний определяет физические и химические свойства пигмента, участвует в образовании комплексов хлорофилла с белками, липидами, фосфолипидами и другими пигментами.
Физические свойства
Спектр поглощения хлорофиллов указывает на максимумы поглощения в красном и сине-фиолетовом участках спектра и не совпадает со спектром излучения Солнца. Солнечный свет имеет максимум при 550 нм, где хлорофиллы а и b не поглощают излучение, в связи с этим листья имеют зелёный цвет, т. к. этот диапазон длин волн ими отражается или пропускается. Также хлорофиллы очень слабо поглощают оранжевые и жёлтые лучи. Спектр поглощения свободных хлорофиллов в органических растворителях отличается от их спектра поглощения в составе пигмент-белковых комплексов мембран тилакоидов.
Поглотив квант света, молекула хлорофилла переходит в одно из возбуждённых (S) состояний, отличающихся по уровню энергии: первое синглетное состояние (S1) – в случае поглощения кванта красного света или второе синглетное состояние (S2) – в случае поглощения кванта синего света. Если возбуждённый электрон меняет спин, то молекула хлорофилла переходит в триплетное состояние. Возврат или дезактивация молекулы хлорофилла из возбуждённого состояния в основное состояние (S0) может происходить различными путями: через совершение фотохимической реакции, флуоресценцию, диссипацию энергии кванта света в тепло, фосфоресценцию, миграцию энергии соседней молекуле пигмента. Благодаря поглощению света в широком спектральном диапазоне и долгоживущим возбуждённым состояниям молекула хлорофилла является мощным фотосенсибилизатором, который не расходуется в реакциях фотосинтеза.
Локализация в клетке
Хлорофилл локализован в пластидах – хлоропластах (высшие растения) и хроматофорах (водоросли), в антенных комплексах (фототрофные бактерии). Молекулы хлорофилла физиологически активны только в связанной с белками форме. В тилакоидных мембранах хлоропластов формируются пигмент-белковые комплексы – фотосистемы. При этом 1 % хлорофиллов находится в реакционных центрах, тогда как остальные 99 % локализованы в светособирающих комплексах.
Полярность молекулы хлорофилла обусловливает её размещение в мембранах тилакоидов: фитольный хвост заякорен в гидрофобный (липидный) слой мембраны, тогда как порфириновое ядро располагается в гидрофильной (белковой) части мембраны и участвует в поглощении света или разделении зарядов.
Формы хлорофиллов
Известные ныне формы хлорофиллов отличаются друг от друга степенью насыщения (системой сопряжённых связей) тетрапиррольного кольца, структурой боковых заместителей и спирта, а следовательно, и спектрами поглощения. Хлорофиллы названы в соответствии с порядком их открытия.
Хлорофилл a (C55H72O5N4Mg) – самая распространённая форма хлорофилла в природе, основной пигмент фотосинтеза. Хлорофилл a входит в состав реакционных центров и светособирающих комплексов всех оксигенных фотосинтезирующих организмов, кроме пурпурных и зелёных серобактерий.
Хлорофилл b (C55H70O6N4Mg) – второй по распространённости пигмент в оксигенных фотосинтезирующих организмах (отсутствует у многих водорослей). Хлорофилл b локализован в светособирающих комплексах и не встречается в реакционных центрах фотосистем. Энергия, поглощённая молекулой хлорофилла b, с высокой эффективностью передаётся молекуле хлорофилла a. Растения с помощью хлорофилла b более эффективно используют энергию света.
Хлорофилл c – локализован в светособирающих комплексах и не входит в состав реакционных центров фотосистем. Наиболее распространённые представители семейства хлорофилла с: хлорофилл с1 (C35H30O5N4Mg); хлорофилл с2 (C35H28O5N4Mg); хлорофилл с3 (C36H28O7N4Mg).
С развитием методов разделения и масс-спектроскопии обнаружены другие представители семейства хлорофилла с, например: хлорофилл с-подобный пигмент DV-PChlide-a или MgDVP (выделен из некоторых видов зелёных водорослей и цианобактерий) и др.
Хлорофилл с содержится в диатомовых, золотистых, криптофитовых, бурых водорослях и у динофлагеллят, при этом в растениях этот пигмент не обнаружен.
Хлорофилл d (C54H70O6N4Mg) – впервые обнаружен в 1943 г. у красных морских водорослей. Хлорофилл d локализован как в светособирающих комплексах, так и реакционных центрах некоторых видов красных водорослей и цианобактерий. Синтез хлорофилла d позволяет этим организмам жить на больших глубинах, поскольку их красный максимум поглощения смещён в более длинноволновую часть.
Хлорофилл e – сообщения о наличии этого пигмента у некоторых видов жёлто-зелёных водорослей, таких как Tribonema bombycinum и Vaucheria hamata, появились в 1940-х гг. Однако до сих пор хлорофилл e не выделен, структурно не охарактеризован и его статус остается неопределённым. Чтобы избежать путаницы, следующий открытый хлорофилл был назван «хлорофилл f», в соответствии с порядком открытия хлорофиллов.
Хлорофилл f (C55H70O6N4Mg) – выделен в 2010 г. из нитчатой цианобактерии Halomicronema hongdechloris, обитающей в строматолитах на побережье Западной Австралии. Молекула хлорофилла f отличается от хлорофилла a наличием в пиррольном кольце I у второго углеродного атома альдегидной группы вместо метильной. Такая замена вызывает сдвиг поглощения в длинноволновую сторону вплоть до 750 нм, фактически в инфракрасную часть спектра. В связи с этим хлорофилл f, как и хлорофилл d, называют «красный хлорофилл». Хлорофилл f является вспомогательным пигментом и локализован только в светособирающем комплексе.
Хлорофилл g – вид искусственного хлорофилла, его химическая структура определена как 7-formyl-Chl dp672. Создан с помощью трансформации симбиотических цианобактерий Acaryochloris marina экспрессионным вектором, содержащим целевой ген phCAO (ген хлорофиллид-а-оксигеназы прохлорофитов Prochlorothrix hollandica), кодирующий хлорофилл b. Полученный трансформант Acaryochloris marina синтезировал в том числе новый хлорофилл с максимумами поглощения при 480 и 672 нм (Tsuchiya. 2012).
Функции хлорофиллов
С помощью хлорофиллов фототрофные организмы избирательно улавливают энергию света, передают резонансную энергию, фотохимически преобразуют энергию возбуждённого состояния в химическую энергию, т. е. осуществляют первичные процессы фотосинтеза. Ведущая роль в этих процессах принадлежит хлорофиллу a как первичному донору электронов, тогда как присутствие других форм хлорофиллов позволяет фотосинтезирующим организмам поглощать свет с различной длиной волны и тем самым более полно использовать спектр фотосинтетически активной радиации.
Биосинтез хлорофиллов
У высших растений, водорослей и многих фотосинтезирующих бактерий биосинтез хлорофилла начинается с превращения глутаминовой или α-кетоглутаровой кислоты в - или 5-аминолевулиновую кислоту (С5-путь). Далее происходит конденсация (циклизация) двух молекул 5-аминолевулиновой кислоты с образованием пятичленного монопиррола – порфобилиногена. 4 молекулы порфобилиногена конденсируются и через ряд ферментативных реакций превращаются в уропорфириноген III, копропорфириноген и, наконец, в протопорфирин IX, в который встраивается атом магния. Важно отметить, что протопорфирин IX – промежуточный продукт в биосинтезе тетрапиррольных пигментов, т. к. является предшественником как хлорофилла, так и гема. Далее через ряд этапов синтезируется протохлорофиллид, который в результате реакции гидрирования двойной связи у С7 и С8 в пиррольном кольце IV (для проведения реакции необходим свет) превращается в хлорофиллид (предшественник хлорофилла, не содержащий остатка фитола). Завершается биосинтез реакцией этерификации остатка пропионовой кислоты в пиррольном кольце IV фитолом с образованием хлорофилла a.
Хлорофилл a является предшественником всех других форм хлорофиллов. Следует отметить, что пути биосинтеза хлорофиллов d и f окончательно не установлены.
Применение хлорофиллов
Наличие у хлорофилла биологически активных свойств обусловливает их широкое использование в фармацевтической (как бактерицидное и антиоксидантное средство), пищевой (как пищевая добавка под маркером Е140 и Е141) и косметической (в качестве красителя) промышленности.
Открытие «красных хлорофиллов» позволяет предположить, что с помощью методов биоинженерии они могут быть введены в водоросли или высшие растения, что позволит им использовать спектральную область 700–750 нм. Это предоставило бы доступ к дополнительному потоку фотонов и способствовало бы повышению эффективности сельского хозяйства.