Органический синтез
Органи́ческий си́нтез, раздел органической химии, в котором рассматриваются пути и методы искусственного создания органических соединений в лаборатории и промышленных масштабах. Широко применим в лабораторных условиях (главным образом для исследовательских целей) и в промышленности (см. в статьях Основной органический синтез, Тонкий органический синтез).
Успешное развитие органического синтеза началось после разработки теории химического строения и накопления сведений о химических свойствах органических соединений (2-я половина 19 в.). С этого времени органический синтез как основной источник новых органических соединений играет фундаментальную роль в становлении органической химии как науки и в её дальнейшем развитии, обеспечивая постоянно расширяющийся круг изучаемых объектов. Развитие органической химии в 20 в. характеризуется всё возрастающим вниманием к синтезу природных соединений и их аналогов, значительным укреплением методической базы (созданием надёжных синтетических методов), началом создания самостоятельной теории органического синтеза. Осуществление синтеза сложнейших природных соединений (например, хлорофилла, цианокобаламина, биополимеров), создание материалов с необычными свойствами (например, органических металлов) показывают, что для современного органического синтеза практически не существует неразрешимых задач.
Обычно синтез целевого соединения осуществляют из относительно простых и доступных (т. е. выпускаемых промышленностью) исходных веществ. Как правило, при синтезе сложных веществ путь от исходных соединений к целевому разбивается на ряд этапов (стадий), на каждом из которых происходит образование одной-двух связей (фрагментов) будущей молекулы или подготовка к образованию таких связей.
Осуществление органического синтеза сопряжено с решением двух основных вопросов: 1) разработка общего плана синтеза, т. е. выбор оптимальных исходных соединений и последовательности стадий, ведущих кратчайшим путём к целевому продукту (стратегия синтеза); 2) выбор (или разработка новых) синтетических методов, обеспечивающих возможность построения необходимой связи в определённом месте собираемой молекулы (тактика синтеза).
Основу тактики органического синтеза составляют различные синтетические методы, каждый из которых представляет собой стандартную совокупность одной или несколько реакций и приёмов выделения продуктов, которые обеспечивают возможность построения или разрыва определённого типа связи (или связей), необходимой для синтеза целевого соединения. Важные характеристики эффективного синтетического метода – общность (слабая зависимость результата от конкретных особенностей структуры исходных соединений), селективность (участие в основных реакциях метода лишь определённых функциональных групп) и высокие выходы продуктов. Типичным примером эффективного синтетического метода может служить синтез олефинов по Виттигу (реакции 1–3) из алкилгалогенидов и карбонильных соединений:
Основные методы органического синтеза можно разбить на 3 группы: 1) конструктивные, ведущие к образованию новых связей С−С, назначение которых – построение скелета будущей молекулы (например, реакция Гриньяра, реакция Фриделя – Крафтса, циклоприсоединение); 2) деструктивные, ведущие к разрыву определённых связей С−С с целью удаления той или иной группировки из молекулы после того, как её роль в синтезе сыграна (например, декарбоксилирование, периодатное окисление диолов); 3) методы трансформации функциональных групп. Последнее важно для введения в молекулы исходных или промежуточных соединений функциональных групп и их защиты (см. в статье Защитные группы), требующихся для осуществления очередной конструктивной реакции, а на заключительных стадиях синтеза – для введения необходимых функциональных групп в целевое соединение.
Методы трансформации функциональных групп (например, превращение спиртов в алкилгалогениды, простые и сложные эфиры, карбонильные соединения и обратные им превращения) хорошо разработаны. Это позволяет говорить о синтетической эквивалентности функциональных групп и целых фрагментов молекул, если они легко взаимопревращаемы. Например, при синтезе замещённых бензиловых спиртов [(4) и (5)] и алкиларилов [(4) и (6)] введение в молекулу арена ацильного остатка (4) в синтетическом плане эквивалентно введению гидроксиалкильного или алкильного остатка, поскольку карбонильная группа в промежуточном кетоне легко может быть восстановлена до спиртовой (5) или до СН2-звена (6):
Принцип синтетической эквивалентности позволяет использовать практически весь арсенал существующих реакций для сборки целевой структуры почти независимо от конкретного распределения (или отсутствия) в ней функциональных групп; например, наращивание углеродной цепи путём алкилирования монозамещённых ацетиленидов можно рассматривать как метод синтеза цис-олефинов, легко получаемых из дизамещённых ацетиленов путём частичного гидрирования.
Рассмотрение вопросов синтетической эквивалентности привело к введению в органический синтез понятия «синтон», под которым подразумевают реальные или нереальные (виртуальные) частицы, присоединение которых к субстрату соответствует введению в него определённой (обычно достаточно крупной и распространённой в органическом соединении) группы. Синтон – понятие абстрактное, описывающее в символическом виде результат каких-либо синтетических операций. Ему должен соответствовать тот или иной реагент (реагенты), участвующий в реальной реакции. Так, например, записанной на синтонном языке реакции (7), ведущей к карбоновым кислотам, соответствуют реальные реакции [(8) и (9)], в которых синтетическим эквивалентом синтона −СООН выступает CN− (записывается −СООН⇔−CN), синтона R+ – алкилгалогенид или алкилсульфонат (R+⇔RX):
Представление о синтонах широко используют для решения тактических и стратегических задач в ретросинтетическом анализе. При этом целесообразно осуществлять разборку (на схемах символ ⇒) целевой молекулы таким образом, чтобы она вела к наиболее «распознаваемым» (т. е. хорошо разработанным и употребительным) синтонам. Так, например, целесообразным путём ретросинтетического анализа карбоновых кислот может служить разборка (а), ведущая к рассмотренным выше синтонам, либо разборка (б), ведущая к синтонам I и II:
Реагентами, эквивалентными синтонам I и II, могут служить соответственно металлоорганические соединения III и СО2, а реальными реакциями, отвечающими такой разборке, – реакции (10) и (11):
Использование синтонного подхода в поиске оптимальных путей синтеза позволяет в значительной мере формализовать (свести к набору некоторых руководящих правил) выбор пути органического синтеза, основывавшийся ранее главным образом на личном опыте и интуиции исследователя. Синтонный подход позволяет иногда прийти чисто логическим путём к решениям эвристического характера. Последнее связано главным образом с использованием «переполяризованных» синтонов, в которых вводимый в молекулу фрагмент характеризуется необычной, парадоксальной с точки зрения обычных представлений органической химии полярностью или структурой. Примером может служить ретросинтетический анализ альдегидов (12), ведущий к электрофильному синтону R+, синтетические эквиваленты которого традиционны, и «парадоксальному» синтону −СН=О. Последний может быть реализован путём использования его синтетического эквивалента – метилен-дитиоацеталя(IV), включение которого в последовательность реакций (13) обеспечивает возможность генерирования карбаниона(V) и получение целевого альдегида.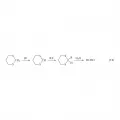 Реакция 13.
Реакция 13.
Таким образом, последовательность реакций (13) эквивалентна первоначальной парадоксальной разборке (12).
Наряду с традиционными синтетическими методами, обеспечивающими сборку одной связи в молекуле, большую роль играют методы, в которых реакция или последовательность реакций обеспечивает образование нескольких связей и одновременно сборку крупного молярного фрагмента, как, например, в аннелировании по Робинсону. Поскольку методы такого типа позволяют решать не только частные тактические задачи, но и вопросы целостного построения ключевого элемента структуры конечного продукта, их принято относить к числу стратегических.
При разработке стратегии сложного органического синтеза используют несколько различных подходов. В логическом отношении наиболее простой из них состоит в последовательной ретросинтетической разборке связей, входящих в целевую молекулу таким образом, чтобы в итоге выйти к подходящим исходным соединениям. Каждый шаг такой разборки должен приводить к распознаваемым синтонам, с тем чтобы обратная операция (сборка соответствующей связи в реальном синтезе) была обеспечена эффективным синтетическим методом. Для любой более или менее сложной органической молекулы можно написать множество ретросинтетических схем, построенных на таком принципе. Это же справедливо и для большинства промежуточных соединений, возникающих на каждом шаге ретросинтетического анализа. В результате строится «древо» решений, выбор оптимального пути в котором требует глубокого анализа. Исследование теоретических основ органического синтеза направлено, в частности, на создание методов отсечения наименований перспективных вариантов и поиск наиболее плодотворных. В этих исследованиях ключевое место занимает понятие стратегической связи, т. е. такой связи, с разборки которой целесообразно начинать ретросинтетический анализ (для целевых и промежуточных соединений). Сформулирован ряд принципов выбора стратегической связи, формализованных до такой степени, что на их основе появилась возможность создания программ для электронно-вычислительных машин с целью осуществления ретросинтетического анализа в т. н. компьютерном синтезе. Однако такой подход имеет ряд недостатков. Один из них состоит в том, что молекула в этом случае рассматривается как сумма ковалентных связей, т. е. без учёта специфики, присущей конкретной структуре как целому.
Тщательный же анализ такой специфики (2-й путь планирования органического синтеза) позволяет в ряде случаев находить неожиданные эвристические решения, обеспечивающие высокую эффективность синтеза. Пример такого решения – трёхстадийный синтез природных производных циклопентаноидов (14), осуществлённый Г. Мета и А. Редди в 1981 г.
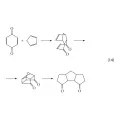 Реакция 14.
Реакция 14.
Третий принцип планирования состоит в выборе той или иной стратегической реакции как ключевой стадии синтеза (например, построение присущего целевому соединению углеродного скелета) с последующей ретросинтетической «подгонкой» целевой структуры к продукту этой реакции. Несмотря на то что такой путь обычно сопряжён с включением в схему синтеза ряда дополнительных стадий (введения, удаления или защиты функциональных групп), он нередко обеспечивает высокую эффективность схемы в целом, поскольку позволяет в одну-две стадии решить основные стратегические задачи синтеза. Так, в синтезе стероидов (разработанном Р. Фанком и К. Фольгардтом в 1980) задача создания полициклического скелета решается с помощью трёх стратегических реакций, выполняемых в одном реакционном сосуде без выделения промежуточных продуктов (реакция 15).
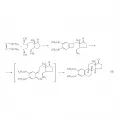 Реакция 15.
Реакция 15.
«Болевая точка» многостадийного синтеза – низкий выход целевого продукта. При среднем выходе на стадию Y общий выход на n стадий составляет Yn = Yn.
Поэтому важно при планировании сложного синтеза минимизировать число стадий и выбирать наиболее эффективные синтетические методы для его осуществления.
Другой путь повышения общего выхода – использование т. н. конвергентных схем синтеза. При традиционном подходе сборка сложной молекулы из фрагментов осуществляется путём последовательного усложнения исходного субстрата в соответствии с «линейной» схемой (16):
В отличие от такого приёма, конвергентные схемы синтеза предполагают параллельную сборку укрупняющихся молярных блоков и заключительную сборку целевой молекулы из двух крупных блоков по схеме типа (17).
 Реакция 17.
Реакция 17.
Для такой полностью конвергентной схемы зависимость общего выхода от числа стадий имеет вид , что обусловливает значительно более слабую зависимость Yn от числа стадий.
Зависимость выхода конечного продукта (в %) от числа стадий (средний выход одной стадии 80 %)
Схема синтеза | Число стадий | ||||
8 | 16 | 32 | 64 | 80 | |
Линейная | 16,8 | 2,8 | 0,08 | 6 · 105 | 2 · 106 |
Конвергентная | 51,2 | 41 | 32,8 | 26 | 24,4 |
Конвергентные схемы имеют также другие преимущества перед линейными: возможность разобщения сходных функциональных групп по разным ветвям схемы, в результате чего значительно упрощаются задачи обеспечения селективности реакций (см. в статье Региоселективность); возможность одновременной проработки различных ветвей схемы, а также внесения необходимых изменений в те или иные участки схемы без нарушения общего стратегического замысла. Осуществимость конвергентного пути синтеза строится на использовании реакций, обеспечивающих возможность сборки молекул из крупных блоков, что, наряду с синтонным подходом, в значительной мере обусловило успехи органического синтеза (синтез хлорофилла, цианокобаламина, полинуклеотидов и др.) и перевод многих чисто препаративных синтезов в промышленные (например, синтез стероидных гормонов и простагландинов).
