Порфирины
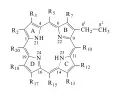
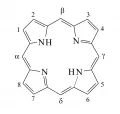
Порфири́ны (от греч. πορφύρα – пурпур), природные и синтетические макрогетероциклические соединения. Молекулы порфиринов содержат 4 гетероцикла пиррола, связанных по положениям 2 и 5 четырьмя метиновыми мостиками в тетрапиррольный макроцикл порфин (формула 1), который обычно имеет несколько различных заместителей по периферийным атомам углерода и атомам углерода метиновых мостиков (мезо-положениям) (формула 2) и может быть координационно связан с ионом металла. Наиболее часто используются названия порфиринов в соответствии с номенклатурой Фишера [нумерация внешних пиррольных атомов углерода Сβ от 1 до 8 и мезо-атомов С от α до δ (формула 1)] и с полусистематической (Гоппе-Зейлер) номенклатурой (нумерация атомов, указанная в формуле 2, и названия по рекомендациям ИЮПАК).
Классификация
Классифицируются на собственно порфирины (различаются природой, числом и положением заместителей R) и аналоги порфиринов (имеют незначительные модификации в структуре макроцикла). Среди собственно порфиринов наиболее важны: этиопорфирины (содержат по 4 этильных Et и метильных Me заместителя; существует 4 изомера положения), прото-, мезо-, гемато- и дейтеропорфирины (четыре Me, два CH2CH2COOH, два соответственно CH=CH2, Et, CH(OH)CH3 и H), копропорфирины (четыре Me и четыре CH2CH2COOH), уропорфирины (четыре CH2CH2COOH и четыре CH2COOH), филлопорфирины (четыре Me, два Et, CH2CH2COOH) и пирропорфирины, (пять Me, два Et, CH2CH2COOH). Среди аналогов порфиринов – азапорфирины (аза-замещённые по метиновым мостикам порфирины – порфиразины, фталоцианины); хлорины (порфирины, гидрированные по С17=С18), бактериохлорины (гидрированные по С7=С8 хлорины); форбин – хлорин с мостиком CH2–CH2 при С13 и С15 и его производные (в том числе феофитины – лиганды хлорофиллов), порфириногены (гидрированные по метиновым мостикам порфирины); N-алкилпорфирины, а также металлопорфирины (комплексы с металлами, относящиеся к макроциклическим комплексным соединениям).
Биологическая роль
Многие порфирины – пигменты биологической природы и могут входить в состав сложных окрашенных белков. Комплексы магния(II) с феофитинами, протохлорофилл, бактериохлорофиллы образуют структуру 10 природных хлорофиллов; протопорфирин и его комплекс с железом(II) входят в состав гемопротеинов – гемоглобина, миоглобина, цитохромов, каталазы, пероксидаз; копропорфирин и уропорфирин содержатся в крови и моче человека и животных; комплексы оксованадия(IV) и никеля(II) с алкилпорфиринами в незначительных количествах содержатся в нефти; комплекс железа(II) с диметильным производным уропорфирина – в хлоропластах и бактериях, его никелевый аналог с некоторыми особенностями строения макроцикла (кофактор F430) – в метаногенных бактериях. Порфирины участвуют в фундаментальных процессах жизнедеятельности, в том числе в фотосинтезе (хлорофиллы, бактериохлорофиллы), транспорте электронов и переносе молекулярного кислорода (гемопротеины), восстановлении сульфита и нитрита (сирогем), заключительной стадии образования метана у метанобразующих бактерий (кофактор F430).
Физико-химические свойства
Порфирины – интенсивно окрашенные (цвет от тёмно-красного до фиолетового) кристаллические вещества, разлагаются при температурах 360–500 °C, слаборастворимы в органических растворителях, нерастворимы в воде. Обладают ароматичностью, относятся к слабым четырёхцентровым амфолитам. Реагируют: с солями металлов в органических растворителях (чаще всего в диметилформамиде при температуре кипения) с образованием металлопорфиринов различного состава; в координированном состоянии – с сильными кислотами при температурах 298–420 °C с диссоциацией и с основаниями или солями в органических растворителях с замещением лигандов, дополнительной координацией или переметаллированием; с электрофильными реагентами с галогенированием, сульфированием, ацилированием и др.; в электрохимическом процессе ступенчато окисляются до дикатиона и восстановливаются (общее число электронов достигает 5–6) до порфириногена (P – исходный порфирин); полимеризуются, сополимеризуются с другими мономерами через боковые цепи или в составе металлопорфиринов; ассоциируются в жидкой и твёрдой фазе до J-агрегатов, плёнок, слоёв.
Порфирины образуют комплексы с большинством элементов периодической системы в степенях окисления от +1 до +6. Самый тяжёлый элемент, с которым получен металлопорфирин – уран. Устойчивые металлопорфирины (распадаются на катион металла и порфирин только в горячей сильной кислоте или в особых условиях) образуются при соблюдении двух основных требований: катион металла должен иметь степень окисления, характеризующуюся низким потенциалом ионизации и электроотрицательностью, достаточной для образования катионом ковалентных связей; расположение четырёх атомов азота порфирина должно соответствовать радиусу катиона металла и его координационному полиэдру. Порфирины образуют комплексы (по группам периодической системы): 2:1 с элементами группы 1 (ионные, непланарные и нестабильные даже в воде), но не образуют 1:1 комплексы (из-за слишком высокого второго потенциала ионизации и радиуса); с элементами группы 2 (преимущественно ионные из-за отсутствия d-орбиталей и способности образовывать квадратный планарный комплекс, с небольшой степенью ковалентности, особенно в случае Be и Mg); с Mg2+ (существенно ковалентные, устойчивые в органических растворителях в отсутствие кислоты из-за высокой поляризационной способности и ковалентного радиуса, идеального для полости молекулы порфирина); с элементами с больши́м ковалентным радиусом Ca, Sr и Ba (лабильные); с типичными комплексообразователями – элементами групп 3–12 (различной устойчивости); с элементами групп 13, 14 и 15 с формальным зарядом +3, +4 и +5 соответственно (устойчивые в полном соответствии с требованиями, упомянутыми выше); с B3+ (сложной стехиометрии по причинам, указанным для Be); с Sn и Pb в степени окисления 2+ (в дополнение к 4+); с P в степени окисления 3+ ( в дополнение к 5+); с Te3+ (комплекс с необычной пятикоординационной, квадратно-пирамидальной геометрией с искажённым тридентатным порфирином).
Синтез
Биосинтез порфиринов в природных объектах происходит из глицина и янтарной кислоты. Синтетические порфирины получают конденсацией пирролов с альдегидами в кислой среде в присутствии кислорода, из пирролов с CH2-группой в α-положении, модифицированием синтетических порфиринов. Промышленное производство коммерческих препаратов хлорофилла осуществляют из растительного сырья (например, из хвойной древесной зелени), как источник гема используется кровь крупного рогатого скота, бактериохлорофилла a – биомасса пурпурных бактерий.
Применение
Порфирины и их комплексы используют: как натуральные красители [хлорофиллы (Е140) и медные комплексы (Е141)]; в оптоэлектронике и электронике (мезогены, молекулярные фотовольтаические и нелинейно-оптические материалы, проводящие полимеры, сдвигающие реагенты); спинтронике (молекулярные магниты, спин-транспортные молекулярные и наносистемы); в катализе (прецизионного макромолекулярного синтеза, реакций оксигенации, асимметричного переноса атомов и групп, образования C–C связи, окисления воды, восстановления кислорода и углекислого газа, диспропорционирования пероксидов); в фотодинамической терапии онкологических и некоторых других заболеваний; в химических, биологических и электрохимических сенсорах; микропористых материалах. Токсичность и воздействие на окружающую среду изучено на примере фотоцитотоксичности порфириновых и хлориновых фотосенсибилизаторов в фотодинамической терапии. Взрывоопасность не изучена.