Серная кислота
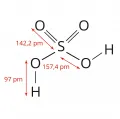
Се́рная кислота́, тетраоксосульфат(VI) водорода, H2SO4; сильная двухосновная неорганическая кислота. Многотоннажный продукт химической промышленности.
Свойства
Безводная серная кислота – бесцветная, очень вязкая и гигроскопичная жидкость без запаха, tпл 10,37 °С; плотность 1834 кг/м3 (20 °С); при нагревании частично разлагается с выделением триоксида серы SO3; перегоняется в виде азеотропной смеси – массовая доля H2SO4 98,3 %, tкип 338,8 °C; при более высоких температурах полностью разлагается. Неограниченно смешивается с водой и SO3; в водных растворах практически полностью диссоциирует на Н3О+, HSO3+ и 2НSO4−; даёт 2 ряда солей – сульфаты и гидросульфаты; образует гидраты H2SO4·nH2O (n = 1, 2, 3, 4); твёрдые гидраты H2SO4·H2O и H2SO4·2H2O имеют ионное строение: (Н3О+)(HSO4−) и (Н3О+)2(SO42−) соответственно. Безводная H2SO4 – неводный растворитель сульфатов металлов. Раствор SO3 в H2SO4 , т. н. олеум, содержит пиросерные кислоты H2S2O7 и H2S3O10.
Серная кислота вытесняет другие кислоты из их солей, нейтрализуется щелочами. Концентрированная H2SO4 – сильный окислитель (восстанавливается до диоксида серы SO2, S и сероводорода H2S); при нагревании окисляет почти все металлы (кроме золота Au и платиновых металлов), неметаллы, бромоводород HBr, иодоводород HI; на холоде в концентрированной H2SO4 некоторые металлы (например, кобальт Co, железо Fe) пассивируются. Разбавленная H2SO4 реагирует с металлами, расположенными в электрохимическом ряду напряжений левее водорода, с выделением Н2. Известны пероксопроизводные: H2SO5 (пероксомоносерная, кислота Каро) и H2S2O8 (пероксодисерная кислота).

Получение
Получение «купоросного масла» (концентрированной серной кислоты) прокаливанием железного или медного купороса описано в трудах алхимиков. Старейший промышленный способ получения серной кислоты (предложен в 1690 Н. Лемери и Н. Лефевром, Франция; реализован Дж. Уордом в 1736 в Твикенхэме и в 1740 в Ричмонде, Англия) включал сжигание смеси серы и селитры и поглощение продукта водой в стеклянном баллоне. В 1746 г. английский технолог Дж. Робек предложил заменить стеклянные баллоны камерами из листового свинца (камерный способ производства). Нитрозный (башенный) способ разработан в 1860 г. английским химиком Дж. Гловером. Принцип контактного способа производства серной кислоты открыт в 1831 г. английским химиком П. Филипсом и получил распространение в начале 20 в. К концу 20 в. контактный способ практически полностью вытеснил нитрозный.
Основные стадии современного производства серной кислоты: обжиг сырья с получением SO2; окисление SO2 до SO3; абсорбция SO3. Сырьём для получения H2SO4 служат в основном сера, железный колчедан (пирит), отходящие газы металлургической промышленности, сероводород нефтепереработки. В России серная кислота из колчедана не производится с 2009 г.
Технология производства серной кислоты контактным способом из серы включает сжигание распыляемого форсунками расплава S в токе подогретого, очищенного от пыли и осушенного воздуха с получением смеси газов, содержащей 10–14 % SO2, которую охлаждают и разбавляют воздухом до содержания SO2 9–10 %. Очищенная, осушенная и подогретая до 420 °С газовая смесь поступает в контактный аппарат на 1-ю стадию окисления на трёх слоях катализатора. Окисленная газовая смесь в олеумном и моногидратном абсорберах (орошаемых олеумом и концентрированной H2SO4) освобождается от SO3, нагревается до 420 °С и поступает на 2-ю стадию окисления на одном или двух слоях катализатора. Далее SO3 отделяется в абсорбере, орошаемом 98%-ной H2SO4, а отходящие газы выбрасываются в атмосферу. Суммарная степень превращения SO2 в SO3 при контактном способе достигает 99,7 %, степень абсорбции SO3 99,97 %. Завод по производству серной кислоты, Республика Бурятия.Мировое производство серной кислоты около 200 млн т/год. Россия занимает 3-е место в мире, в 2020 г. производство серной кислоты составило 14 млн т.
Завод по производству серной кислоты, Республика Бурятия.Мировое производство серной кислоты около 200 млн т/год. Россия занимает 3-е место в мире, в 2020 г. производство серной кислоты составило 14 млн т.
В России производятся следующие товарные сорта серной кислоты (в % по массе H2SO4): техническая (92,5–94,0 %), аккумуляторная (92–94 %), особой чистоты (93,5–95,6 %) и реактивная (93,6–95,6 %), а также олеум технический (19–24 % свободного SO3).
Применение
Серная кислота используется для производства минеральных удобрений (60 %), как электролит в свинцовых аккумуляторах, в гидрометаллургии для вскрытия комплексных руд, для получения фосфорной, соляной, борной, плавиковой и других кислот, солей, в нефтяной промышленности (очистка нефтепродуктов от сернистых и ненасыщенных органических соединений), в металлообработке (удаление окалины с проволоки и листов перед лужением и оцинковкой, травление металлических поверхностей перед нанесением гальванических покрытий), в промышленном органическом синтезе (реакции этерификации, сульфирования, алкилирования и др.), как водоотнимающее средство (осушка газов, концентрирование азотной кислоты) и др.
Серная кислота и олеум – химически чрезвычайно агрессивные вещества, поражают дыхательные пути, кожу, слизистые оболочки, вызывают затруднение дыхания, кашель, ларингит, трахеит, бронхит. Обращаться с серной кислотой в лаборатории и на производстве следует с осторожностью, используя средства защиты (очки, резиновые перчатки, фартуки, сапоги). При разбавлении необходимо лить H2SO4 в воду тонкой струёй при перемешивании (приливание воды к концентрированной H2SO4 вызывает разбрызгивание из-за большого тепловыделения).
Аэрозоль H2SO4 может образоваться в атмосфере в результате выбросов теплоэлектростанций, химических и металлургических производств, содержащих оксиды серы, и выпадать в виде кислотных дождей.