Гидроксиды
Гидрокси́ды, неорганические соединения металлов общей формулы M(OH)n, где n – степень окисления металла M. Являются основаниями или амфотерными соединениями. Гидроксиды щелочных, щёлочноземельных металлов и одновалентного таллия называются щелочами.
Физико-химические свойства
Кристаллические решётки гидроксидов щелочных и щёлочноземельных металлов содержат ионы OH−, которые легко обнаруживаются по широкой полосе в ИК-спектре при 3600 см−1. Щёлочи при растворении в воде подвергаются электролитической диссоциации с образованием гидратированных ионов OH− и аквакатионов металла. В концентрированных неводных растворах гидроксидов щелочных металлов возможно образование ионных пар, например (K+·OH−), c включением в их состав молекул растворителя. Гидроксиды щелочных металлов хорошо растворяются в воде, гидроксиды остальных металлов малорастворимы и часто выделяются из водного раствора в виде гелей переменного состава, содержащих молекулы воды.
К амфотерным гидроксидам относят Be(OH)2, Zn(OH)2, Al(OH)3, Ga(OH)3, Sn(OH)2, Pb(OH)2, CrO(OH) и др. При взаимодействии с кислотами они образуют соли, с сильными основаниями – гидроксокомплексы. Например, гидроксид цинка может реагировать как с кислотой, так и с основанием:
Гидроксиды многих металлов, особенно элементов IV B группы периодической системы, склонны к поликонденсации в результате процесса оляции – образования мостиковых групп OH. При этом гидроксиды превращаются в сложные нестехиометрические соединения – многоядерные гидроксоаквакомплексы, содержащие такие, например, фрагменты, как на рис. 1.
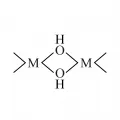 Рис. 1. Фрагмент многоядерного гидроксоаквакомплекса.Образованию этих соединений способствует повышение температуры, концентрации раствора и водородного показателя (pH). При старении осадка многоядерных гидроксоаквакомплексов гидроксогруппы необратимо превращаются в оксогруппы (процесс оксоляции, рис. 2):
Рис. 1. Фрагмент многоядерного гидроксоаквакомплекса.Образованию этих соединений способствует повышение температуры, концентрации раствора и водородного показателя (pH). При старении осадка многоядерных гидроксоаквакомплексов гидроксогруппы необратимо превращаются в оксогруппы (процесс оксоляции, рис. 2):
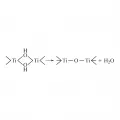 Рис. 2. Оксоляция гидроксоаквакомплекса титана.Многие гидроксиды и их водные растворы поглощают СО2 из воздуха с образованием карбонатов, с кислотами дают соли. При нагревании гидроксиды щелочных металлов, кроме LiOH, плавятся, а остальные, в том числе и LiOH, разлагаются на оксид металла и воду, например:
Рис. 2. Оксоляция гидроксоаквакомплекса титана.Многие гидроксиды и их водные растворы поглощают СО2 из воздуха с образованием карбонатов, с кислотами дают соли. При нагревании гидроксиды щелочных металлов, кроме LiOH, плавятся, а остальные, в том числе и LiOH, разлагаются на оксид металла и воду, например:
Гидроксиды Cu(I), Ag(I), Au(I) разлагаются на воду и оксид в процессе их образования.
Получение
Гидроксиды щелочных металлов получают: электролизом водных растворов солей, чаще всего хлоридов; методом ионного обмена с использованием анионитов в OH-форме; иногда по обменным реакциям, например:
Гидроксиды остальных металлов получают в основном по обменным реакциям. В отдельных случаях гидроксиды щёлочноземельных металлов синтезируют взаимодействием их оксидов с водой, например:
Нахождение в природе
Гидроксиды встречаются в природе в виде минералов, например гидраргиллита Al(OH)3, брусита Mg(OH)2.
Номенклатура
Систематические названия гидроксидов составляются по обычным номенклатурным правилам. Например: NaOH – гидроксид натрия; Fe(OH)2 – гидроксид железа(II); Al(OH)3 – гидроксид алюминия.
Если в гидроксиде электроотрицательная составляющая включает оксидные и гидроксидные анионы одновременно, то в систематических названиях используются числовые приставки: TiO(OH)2 – дигидроксид-оксид титана; MoO(OH)3 – тригидроксид-оксид молибдена.
Для соединений, содержащих группу O(OH), используют традиционные названия с приставкой мета-: FeO(OH) – метагидроксид железа; CrO(OH) – метагидроксид хрома.
Для оксидов, гидратированных неопределённым числом молекул воды, например, Fe2O3·nH2O, недопустимо писать формулы типа Fe(OH)3. Называть такие соединениями гидроксидами также не рекомендуется. Примеры систематических названий: Au2O3·nH2O – полигидрат оксида золота(III); MnO2·nH2O – полигидрат оксида марганца(IV).
Особо следует отметить гидрат аммика NH3·H2O, называемый раньше гидроксидом аммония NH4OH.

