Галогенирование
Галогени́рование (галоидирование), введение атома галогена в молекулу органического соединения. Осуществляют путём реакций замещения (заместительное галогенирование) или присоединения (присоединительное галогенирование). Наибольшее значение в промышленности имеет хлорирование. Эмпирические правила замещения в органических соединениях водорода хлором впервые сформулировал в 1833–1834 гг. Ж.-Б. Дюма.
Заместительное галогенирование
Лёгкость заместительного галогенирования уменьшается в ряду: F2→Cl2→Br2→I2. Из-за высокой экзотермичности фторирование фтором проводят при низких температурах и при разбавлении азотом. Часто вместо F2 используют фторсодержащие соединения CoF3, HgF2, HF. Промышленно важным является способ получения хладонов заместительным фторированием алкилхлоридов газообразным HF в присутствии SbCl5 при 70–150 °C и давлении до 2,5 МПа ( ), а также электрохимическим фторированием безводным HF.
Последовательное заместительное хлорирование или бромирование алканов (реакция металепсии) и алкилароматическое соединений в боковую цепь Cl2 или Br2 протекает по радикально-цепному механизму под действием высоких температур, света, ионизирующего излучения, других энергетических факторов либо радикальных инициаторов (азосоединения, пероксиды и гидропероксиды). 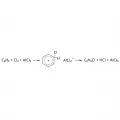 Реакция галогенирования.Заместительное хлорирование и бромирование в ядро ароматических и гетероароматических соединений с использованием катализаторов (обычно апротонных кислот, например, AlCl3 или AlBr3 соответственно) протекает по механизму электрофильного замещения. Для заместительного галогенирования в зависимости от природы субстрата используются различные реагенты; например, для ароматических карбоновых кислот – Cl2 или Br2 в присутствии фосфора, для замены группы OH в спиртах – HCl или HBr, для замены карбонильного кислорода в альдегидах или кетонах – PCl5 или PBr5, для замены группы NH2 на Cl2 или Br2 в ароматических соединениях – продукты каталитического разложения соответствующих солей диазония в присутствии порошка Cu или солей Cu(I), и пр.
Реакция галогенирования.Заместительное хлорирование и бромирование в ядро ароматических и гетероароматических соединений с использованием катализаторов (обычно апротонных кислот, например, AlCl3 или AlBr3 соответственно) протекает по механизму электрофильного замещения. Для заместительного галогенирования в зависимости от природы субстрата используются различные реагенты; например, для ароматических карбоновых кислот – Cl2 или Br2 в присутствии фосфора, для замены группы OH в спиртах – HCl или HBr, для замены карбонильного кислорода в альдегидах или кетонах – PCl5 или PBr5, для замены группы NH2 на Cl2 или Br2 в ароматических соединениях – продукты каталитического разложения соответствующих солей диазония в присутствии порошка Cu или солей Cu(I), и пр.
Присоединительное галогенирование
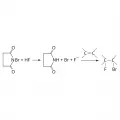 Реакция галогенирования фторводородом.Присоединительное галогенирование по кратной связи может протекать как по радикальному (например, присоединение Cl2 или Br2 к ароматическим и гетероароматическим соединениям под действием света или при нагревании ), так и по ионному (электрофильное присоединение Cl2 к алкенам) механизму. Присоединение галогенов можно осуществлять действием галогеноводородов.
Реакция галогенирования фторводородом.Присоединительное галогенирование по кратной связи может протекать как по радикальному (например, присоединение Cl2 или Br2 к ароматическим и гетероароматическим соединениям под действием света или при нагревании ), так и по ионному (электрофильное присоединение Cl2 к алкенам) механизму. Присоединение галогенов можно осуществлять действием галогеноводородов.
Галогенирование под действием галогеноводородов (HCl и HBr) и окислителя (H2O2 для жидкой фазы, O2 – для газовой) называют окислительным галогенированием.
Применение
Галогенирование используют для получения галогенпроизводных углеводородов, хлорорганических соединений, фторорганических соединений и пр. Окислительным хлорированием этилена в промышленности получают дихлорэтан.
