Газ
Газ (франц. gaz, от лат. chaos, от греч. χάος – хаос), агрегатное состояние вещества, в котором его атомы или молекулы не связаны или очень слабо связаны силами взаимодействия и заполняют весь предоставленный им объём. Термин «газ» предложен в начале 17 в. Я. Б. ван Гельмонтом. Вещество в газообразном состоянии широко распространено в природе. Газы образуют атмосферу Земли, в значительных количествах содержатся в твёрдых земных породах (газы природные), растворены в воде океанов, морей и рек. Звёзды, облака межзвёздного вещества, туманности, атмосферы планет состоят из газов – нейтральных или ионизованных (плазмы).
Любое вещество в зависимости от давления и температуры может существовать в твёрдом, жидком или газообразном состоянии. Область существования газообразного состояния графически удобно изобразить в переменных: давление – температура (, -диаграмма, рисунок).
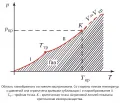 𝑝, 𝑇-диаграмма состояния вещества.При температурах ниже критической (критическое состояние вещества) эта область ограничена кривыми сублимации I и парообразования II. В состояниях на кривой I (ниже тройной точки ) газ находится в равновесии с твёрдой фазой, а на кривой II (между
𝑝, 𝑇-диаграмма состояния вещества.При температурах ниже критической (критическое состояние вещества) эта область ограничена кривыми сублимации I и парообразования II. В состояниях на кривой I (ниже тройной точки ) газ находится в равновесии с твёрдой фазой, а на кривой II (между
и ) – с жидкой фазой. Газ в этих состояниях обычно называют паром вещества. При переходе через эти кривые пар конденсируется, переходя в твёрдое или жидкое состояние. Процессы конденсации газов, особенно сжижение газов, имеют важное техническое значение.
При > фазовые превращения не происходят, и иногда за условную границу между газом и жидкостью принимают критическую изохору вещества, в непосредственной близости от которой свойства вещества изменяются особенно быстро.
Свойства газа при изменении температуры и давления могут меняться в широких пределах. Так, в нормальных условиях (при 0 °C и атмосферном давлении) плотность газа примерно в 1000 раз меньше плотности того же вещества в твёрдом или жидком состоянии. При комнатной температуре и высоком вакууме плотность газа может составлять 10−17 кг/м3. В космическом пространстве плотность газа может быть ещё на 10 порядков меньше
(10−27 кг/м3). При весьма высоких давлениях вещество, которое при > можно считать газом, обладает огромной плотностью (например, в центре некоторых звёзд плотность порядка 1012 кг/м3). В зависимости от условий в широких пределах изменяются и другие свойства газа.
Идеальный газ
Для описания изменения плотности газа с температурой и давлением используются различные уравнения состояния – либо эмпирические, либо основанные на некоторых физических моделях газа. В частности, молекулярно-кинетическая теория рассматривает газ как совокупность слабо взаимодействующих молекул или атомов, находящихся в хаотическом (тепловом) движении. На основе этих простых представлений удаётся объяснить основные физические свойства газа, особенно полно – свойства разреженных газов. Газ, молекулы которого рассматриваются как не взаимодействующие друг с другом материальные точки, называется идеальным газом.
Для разреженных газов широко применяется уравнение состояния идеального газа, называемое уравнением Клапейрона:
где – универсальная газовая постоянная, – объём 1 моля газа. Уравнение Клапейрона обобщает эмпирические газовые законы (закон Бойля – Мариотта, законы Гей-Люссака). Из уравнения (1) следует, что при одинаковых и идеальные газы, взятые в количестве 1 моля, имеют равные объёмы.
С помощью дифференциальных уравнений термодинамики, зная уравнение состояния газа, можно определить зависимость его калорических свойств (теплоёмкости, внутренней энергии, энтропии) от плотности или давления. В частности, для идеального газа теплоёмкость и внутренняя энергия не зависят от плотности.
Процессы переноса в газах
При наличии градиентов температуры, давления и концентрации компонентов в газах возникают процессы переноса. Молекулярно-кинетическая теория рассматривает их с единой точки зрения: диффузию как перенос молекулами массы, теплопроводность как перенос ими энергии, вязкость как перенос количества движения. Процессы переноса возникают, поскольку молекулы газа взаимодействуют (сталкиваются) между собой. Поэтому модель идеального газа для анализа явлений переноса непригодна. В простейшем случае явления переноса в газах рассматриваются для разреженного газа, молекулы которого в первом приближении считаются упругими шариками с определённым диаметром, причём эти шарики взаимодействуют друг с другом только в момент соударения. В этом приближении диаметр молекулы связан простым соотношением с её средней длиной свободного пробега . В частности, если характерный размер объёма, занимаемого газом, больше , то теплопроводность и вязкость газа не зависят от давления. Наоборот, когда больше характерного размера, теплопроводность и вязкость газа с уменьшением давления падают. На этом явлении, в частности, основаны теплоизолирующие свойства сосудов Дьюара.
В более строгой молекулярной теории при анализе явлений переноса в разреженных газах учитывается взаимодействие молекул при любых расстояниях между ними. Характер взаимодействия определяется т. н. потенциалом взаимодействия (межмолекулярного взаимодействия).
Реальные газы
При повышении плотности уравнение состояния (1) оказывается неприменимым, т. к. среднее расстояния между молекулами газа становятся сравнимыми с радиусом межмолекулярного взаимодействия. Для описания термодинамических свойств неидеальных, или, как их чаще называют, реальных, газов пользуются различными уравнениями состояния. Простейшим примером уравнения, которое качественно правильно описывает основные отличия реального газа от идеального, служит уравнение Ван дер Ваальса. Оно учитывает, с одной стороны, существование сил притяжения между молекулами (их действие приводит к уменьшению давления газа), с другой – сил отталкивания, препятствующих безграничному сжатию газа.
К наиболее теоретически обоснованным, во всяком случае для состояний, удалённых от критической точки, относится вириальное уравнение состояния, представляющее собой разложение в ряд по степеням величины = . Коэффициенты этого ряда (вириальные коэффициенты) определяются соударениями молекул (парными, тройными и более высокого порядка) и являются функциями только температуры. В газах сравнительно малой плотности наиболее вероятны парные столкновения. При т. н. температуре Бойля (точка Бойля) умеренно плотный газ ведёт себя как идеальный, т. е. подчиняется уравнению (1). Физически это означает, что при межмолекулярные силы притяжения и отталкивания практически компенсируют друг друга.
Межмолекулярное взаимодействие в той или иной степени сказывается на всех свойствах реальных газов. Внутренняя энергия реального газа оказывается зависящей от плотности или давления. Это взаимодействие определяет изменение температуры реального газа при адиабатическом расширении без совершения работы, называемом дросселированием. Мерой изменения температуры газа при дросселировании служит коэффициент Джоуля – Томсона, который в зависимости от условий может быть положительным (охлаждение газа), отрицательным (нагрев газа) либо равным нулю при т. н. температуре инверсии (эффект Джоуля – Томсона). Эффект охлаждения газа при дросселировании применяется в технике сжижения газов.
Внутреннее строение молекул слабо влияет на уравнение состояния газа. Напротив, калорические свойства газа, а также его электрические и магнитные свойства существенно зависят от внутреннего строения молекул: наличия колебаний атомов в молекуле, различных форм вращения, возбуждения электронных уровней (т. е. числа внутренних степеней свободы ). В соответствии с законом равнораспределения на каждую степень свободы молекулы газа приходится одинаковая энергия. Отсюда теплоёмкость 1 моля идеального газа равна .
Для расчёта зависимости калорических свойств газа от температуры необходимо знать уровни энергии молекулы, сведения о которых в большинстве случаев получают из анализа спектров газа. Для большого числа веществ в приближении идеального газа калорические свойства вычислены с высокой точностью и их значения представлены в виде таблиц.
Электрические свойства газа связаны в первую очередь с возможностью ионизации молекул или атомов, т. е. с появлением в газе электрически заряженных частиц (ионов и электронов). При отсутствии заряженных частиц газы являются хорошими диэлектриками. С ростом концентрации зарядов электрическая проводимость газов увеличивается (электрические разряды в газах).
При температурах начиная с нескольких тысяч градусов всякий газ частично ионизуется и превращается в плазму. Если концентрация зарядов в плазме невелика, то её свойства мало отличаются от свойств обычного газа.
По магнитным свойствам газы делятся на диамагнитные (к ним относятся, например, благородные газы, , , , пары́ H2O) и парамагнитные (например, ). Диамагнитными являются газы, молекулы которых не имеют постоянного магнитного момента и приобретают его лишь под влиянием внешнего поля. Газы, у которых молекулы обладают постоянным магнитным моментом, во внешнем магнитном поле ведут себя как парамагнетики.
Учёт межмолекулярного взаимодействия и внутреннего строения молекул необходим при решении многих проблем физики газов, например при исследовании влияния верхних разреженных слоёв атмосферы на движение ракет и спутников (газовая динамика, динамика разреженных газов).
В современной физике газом называют не только одно из агрегатных состояний вещества. К газам с особыми свойствами (квантовым газам) относят, например, совокупность свободных электронов в металле (электронный газ), фононов в жидком гелии (фононный газ). Свойства бозе-газов (например, газы фотонов, π-мезонов, фононов) описывает квантовая статистика Бозе – Эйнштейна, свойства ферми-газов (например, газ электронов, нейтронов, нейтрино, дырок проводимости и др.) рассматривает квантовая статистика Ферми – Дирака.
