Нитрование
Нитрова́ние, введение нитрогруппы (–NO2) в молекулу органического соединения. Различают: прямое нитрование – замещение атома водорода при атоме углерода (образуются C-нитросоединения, С-нитрование), в гидроксильной группе (образуются нитраты R–ONO2, О-нитрование), в аминогруппе (образуются нитрамины RNHNO2, N-нитрование); заместительное нитрование – замещение атома галогена, сульфо-, диазо- и другой функциональной группы; присоединительное нитрование – присоединение нитрогрупп по кратной углерод-углеродной связи. Наибольшее значение в промышленности имеет С-нитрование.
Нитрующими агентами служат азотная кислота HNO3, нитрующие смеси – смеси концентрированной HNO3 или оксидов азота N2O4 и N2O5 с неорганическими (H2SO4, АlСl3, ZnCl2, BF3 и др.) или органическими (чаще всего уксусным ангидридом) веществами, соли нитрония NO+2Х– (где Х– – BF–4, SbF–4, ClO–4, Cl–, Br–, F–), соли азотистой кислоты MNO2 (M – щелочной металл).
Нитрование – быстрая, необратимая и экзотермическая реакция. Основным побочным процессом при нитровании является окисление. Возможен электрофильный, нуклеофильный или радикальный механизм нитрования; активными частицами в этих реакциях являются соответственно катион нитрония NO2+ нитрит-анион NO2– или радикал NО • 2.
При электрофильном нитровании нитрующим агентом, как правило, является HNO3, способная генерировать NO+2 в результате самопротонирования: Смеси с веществами, которые связывают воду (H2SO4, олеумом), используют для увеличения реакционной способности HNO3. В случае слабой взаимной растворимости нитрующего агента и субстрата, а также для уменьшения образования побочных продуктов нитрование проводят в полярных органических растворителях (например, нитрометане, уксусной кислоте), которые способствуют диссоциации [H2NO3]+ с образованием NO+2.
Электрофильный механизм является основным при нитровании ароматических соединений, которое протекает по схеме:
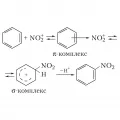 Механизм электрофильного нитрования.Реакция осуществляется при комнатной или пониженной температуре. Для введения последующих нитрогрупп требуются более жёсткие условия. При прямом нитровании в ароматическое ядро можно ввести максимально три нитрогруппы. Наличие электронодонорных (амино-, сульфо- и др.) функциональных групп облегчает нитрование; в некоторых случаях эти группы могут замещаться на нитрогруппы (например, сульфогруппа замещается нитрогруппой при нитровании фенолсульфокислот). Ароматические соединения с электронодонорными заместителями нитруются в орто- и пара-положения, с электроноакцепторными – в мета-положение.
Механизм электрофильного нитрования.Реакция осуществляется при комнатной или пониженной температуре. Для введения последующих нитрогрупп требуются более жёсткие условия. При прямом нитровании в ароматическое ядро можно ввести максимально три нитрогруппы. Наличие электронодонорных (амино-, сульфо- и др.) функциональных групп облегчает нитрование; в некоторых случаях эти группы могут замещаться на нитрогруппы (например, сульфогруппа замещается нитрогруппой при нитровании фенолсульфокислот). Ароматические соединения с электронодонорными заместителями нитруются в орто- и пара-положения, с электроноакцепторными – в мета-положение.
Другие субстраты для электрофильного нитрования – гетероциклические соединения, ненасыщенные углеводороды, относительно сильные СН-кислоты, амины, спирты. Нитрование третичных аминов концентрированной HNO3 или её смесью с уксусным ангидридом сопровождается разрывом связи С–N (т. н. нитролиз); реакцию широко используют в производстве взрывчатых веществ (например, для получения гексогена и октогена из уротропина).
Нуклеофильное нитрование осуществляют солями азотистой кислоты: . В реакцию вступают алкилгалогениды, α-галогенкарбоновые кислоты и их эфиры, алкилсульфаты. В качестве нитрующих агентов используют нитриты щелочных металлов в апротонных диполярных растворителях (диметилформамид, диметилсульфоксид, ацетонитрил и др.) или в присутствии краун-эфиров.
Радикальный механизм является основным при нитровании алканов. Источником NO • 2 служат HNO3 и оксиды азота.
Нитрование насыщенных углеводородов разбавленной HNO3 при повышенной температуре впервые осуществил в 1888 г. российский химик М. И. Коновалов (реакция Коновалова). В отсутствие инициаторов реакция протекает по схеме: В промышленности нитроалканы получают жидкофазным (при нормальном или повышенном давлении, температуре выше 180 °C, время контакта около 15 с) и парофазным (при давлении 0,7–1,0 МПа, температуре 400–500 °C, время контакта около 1 с) нитрованием смеси алканов азотной кислотой. Эти методы используются также для нитрования алифатических боковых цепей жирноароматических соединений.
Присоединение нитрогруппы по кратной углерод-углеродной связи может происходить по радикальному, ионному или смешанному (анион-радикальному) механизму в зависимости от условий процесса и реагентов. Алкены, циклоалкены, диалкил- и диарилалкины обычно нитруются оксидом N2O4 с образованием вицинальных динитросоединений, β-нитронитритов и β-нитронитратов, которые легко отщепляют HNO3 и HNO2, давая ненасыщенные нитросоединения. Формально нитрование ненасыщенных соединений можно рассматривать как замещение на нитрогруппы атомов водорода, находящихся при атомах углерода кратной связи.
Систематическое применение реакции началось с открытия Э. Митчерлихом в 1834 г. нитрование бензола. Нитрование имеет большое научное и промышленное значение, поскольку является основным методом синтеза нитросоединений алифатических и ароматических рядов.
Реакция нитрования взрывоопасна. В промышленности нитрование проводят в специальных антикоррозионных нитраторах в тщательно контролируемых условиях.
