Растворители
Раствори́тели, индивидуальные химические соединения или смеси, способные растворять различные вещества – образовывать с ними гомогенные системы, состоящие из двух или более компонентов (растворы). Для смесей жидкость – газ и жидкость – твёрдое тело растворителем обычно считают жидкость, для двух- и многокомпонентных растворов растворителем считают компонент, содержание которого существенно выше содержания остальных компонентов. Чаще всего растворители классифицируют на основе их химического строения или физических свойств.
Классификация
По химическому строению растворители подразделяют на органические и неорганические. Органические растворители относятся к следующим классам соединений: алифатические и ароматические углеводороды, их галогено- и нитропроизводные, спирты, карбоновые кислоты, простые и сложные эфиры, амиды кислот, нитрилы, альдегиды и кетоны, сульфоксиды и др.
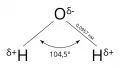 Строение молекулы воды.
Архив БРЭ.Важнейший неорганический растворитель – вода. К неорганическим растворителям относятся легкоплавкие галогениды (например, фторид брома BrF3), оксогалогениды (например, сульфурилхлорид, тионилхлорид), азотсодержащие соединения (жидкий аммиак NH3, гидразин, гидроксиламин и др.), а также жидкий диоксид серы SO2, фтороводородная кислота и др., в некоторых случаях применяют легкоплавкие металлы (галлий, олово и др.). Расплавы солей, которые, будучи электролитами, являются отличными растворителями для солей и металлов, пригодны также в качестве среды для проведения органических реакций. Используют как легкоплавкие солевые расплавы (нитратные, ацетатные), так и относительно тугоплавкие (галогенидные, боратные, фосфатные, молибдатные, ванадатные и т. п.). Широко применяют расплавы оксидов (РbО, Bi2O3, В2О3), а также смешанные (например, РbО и PbF2). Используют также классификацию растворителей по кислотно-оснóвным свойствам, выделяя кислотные, оснóвные и нейтральные растворители.
Строение молекулы воды.
Архив БРЭ.Важнейший неорганический растворитель – вода. К неорганическим растворителям относятся легкоплавкие галогениды (например, фторид брома BrF3), оксогалогениды (например, сульфурилхлорид, тионилхлорид), азотсодержащие соединения (жидкий аммиак NH3, гидразин, гидроксиламин и др.), а также жидкий диоксид серы SO2, фтороводородная кислота и др., в некоторых случаях применяют легкоплавкие металлы (галлий, олово и др.). Расплавы солей, которые, будучи электролитами, являются отличными растворителями для солей и металлов, пригодны также в качестве среды для проведения органических реакций. Используют как легкоплавкие солевые расплавы (нитратные, ацетатные), так и относительно тугоплавкие (галогенидные, боратные, фосфатные, молибдатные, ванадатные и т. п.). Широко применяют расплавы оксидов (РbО, Bi2O3, В2О3), а также смешанные (например, РbО и PbF2). Используют также классификацию растворителей по кислотно-оснóвным свойствам, выделяя кислотные, оснóвные и нейтральные растворители.
Классификация растворителей по их физическим свойствам может быть основана на их температуре кипения (растворители с tкип ниже 100 °C при 760 мм рт. ст. относят к низкокипящим, с tкип выше 150 °C – к высококипящим), летучести (легколетучие, среднелетучие и труднолетучие), вязкости (при вязкости менее 2 мПа·с при 20 °C растворители относят к маловязким, при вязкости 2–10 мПа·с – средней вязкости, при вязкости более 10 мПа·с – к высоковязким), наличии или отсутствии дипольного момента молекул растворителя и величине диэлектрической проницаемости (полярные и неполярные).
Молекулы растворителя могут выступать по отношению к растворённому веществу в качестве доноров (акцепторов) протонов или электронов. На основе этой функции и с учётом величины диэлектрической проницаемости различают четыре группы растворителей: протонные (вода, спирты, карбоновые кислоты и др.), которые являются хорошими донорами протонов и обладают высокой диэлектрической проницаемостью (); апротонные диполярные (некоторые апротонные амиды, кетоны, сульфоксиды и др.), обладающие высокой диэлектрической проницаемостью, но не обладающие донорно-акцепторными свойствами; электронодонорные (например, эфиры); неполярные (сероуглерод, углеводороды), которые обладают низкой диэлектрической проницаемостью () и не обладают донорно-акцепторными свойствами ни по отношению к протону, ни по отношению к электрону.
Растворители также классифицируют в зависимости от их пожаро- и взрывоопасности, токсичности и других характеристик.
Выбор растворителя
Выбор оптимального растворителя с целью его практического использования определяется суммой различных факторов: физическими свойствами (плотностью, вязкостью, показателем преломления, диэлектрической проницаемостью и др.), растворяющей способностью, химической инертностью к растворяемому веществу и аппаратуре, стабильностью при воздействии внешних факторов (температуры, света, влаги и т. д.) и наличием примесей, пожаро- и взрывоопасностью, токсичностью, доступностью, стоимостью и др.
Поскольку подавляющее большинство химических реакций происходит в растворах, очень важна роль растворителя как реакционной среды. Растворители не только создают гомогенную среду, обеспечивая контакт между реагирующими частицами (ионами, молекулами), но благодаря взаимодействию с исходными, промежуточными веществами и продуктами могут влиять на порядок и скорость химической реакций, химическое равновесие, а иногда определять направление реакции. Существует ряд эмпирических зависимостей между свойствами растворителя и скоростью и направлением химической реакции.
Применение
Применение растворителей не ограничивается их использованием в качестве среды для проведения химических реакций. В лакокрасочной промышленности растворители – компоненты лакокрасочных материалов, обеспечивающие растворение плёнкообразующих веществ (ксилол, толуол, скипидар, спирты, кетоны, ацетаты и др.), в текстильной – используются для крашения, а также для химической чистки одежды (перхлорэтилен). Широко применяют растворители для обезжиривания металлов и их сплавов как в условиях холодной очистки (метиленхлорид, спирты), так и в процессе парожидкостного обезжиривания (трихлорэтилен, перхлорэтилен, бензин, керосин и др.). При обезжиривании металлических поверхностей, особенно состоящих из цветных металлов или их сплавов, хлорировованные углеводороды и некоторые другие растворители обязательно стабилизируют веществами, предотвращающими разложение растворителей. В химической технологии и лабораторной практике растворители используют для процессов перекристаллизации и экстракции, в спектроскопии и хроматографии, в аналитической химии (например, для титрования), в сверхкритических флюидных технологиях и др.
Проблема утилизации растворителей имеет исключительно важное значение с экономической, санитарно-гигиенической и экологической точек зрения. Наиболее экономичные процессы утилизации растворителей – возврат их в рабочий цикл с помощью рекуперации (конденсацией паров растворителей или их поглощением жидкими или твёрдыми сорбентами) и регенерации (дистилляцией или ректификацией отработанных растворов).
