Реакция Фриделя – Крафтса
Реа́кция Фриде́ля – Крафтса, метод введения алкильных или ацильных заместителей в ароматические соединения.
История
В 1877 г. Ш. Фридель и Дж. М. Крафтс открыли ряд реакций, заключающихся в замещении атома водорода в ароматическом соединении различными остатками. Реакции протекают в присутствии, в качестве катализатора, кислоты Льюиса – хлорида алюминия (AlCl3). Наиболее типичными примерами реакции Фриделя – Крафтса являются реакции алкилирования (взаимодействие с галогеналканами, алкенами, спиртами или сложными эфирами) и ацилирования (взаимодействие с карбоновыми кислотами и их производными) (рис. 1).
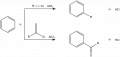 Рис. 1. Общая схема реакции Фриделя – Крафтса.
Рис. 1. Общая схема реакции Фриделя – Крафтса.
Механизм реакции алкилирования
Реакция Фриделя – Крафтса является одной из типичных реакций электрофильного замещения в ароматическом ряду. На первом этапе при взаимодействии галогеналкана с кислотой Льюиса происходит поляризация связи «углерод – галоген», что увеличивает электрофильность атома углерода (больший положительный заряд) (рис. 2).
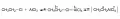 Рис. 2. Образование каталитического комплекса.Степень поляризации зависит от природы заместителя в галогеналкане и от применяемого катализатора. Наиболее широко применяемыми катализаторами являются хлориды алюминия и железа (III), фторид бора, а их эффективность уменьшается в следующем ряду:
Рис. 2. Образование каталитического комплекса.Степень поляризации зависит от природы заместителя в галогеналкане и от применяемого катализатора. Наиболее широко применяемыми катализаторами являются хлориды алюминия и железа (III), фторид бора, а их эффективность уменьшается в следующем ряду:
Образующаяся комплексная частица далее взаимодействует с ароматическим субстратом. При этом реакция протекает по классическому механизму присоединения-отщепления SEAr. Сначала образуется π-комплекс, который далее переходит в σ-комплекс (аренониевый ион). В σ-комплексе циклическая ароматическая 6-электронная система исчезает и заменяется на нециклическую 4-электронную сопряжённую систему циклогексадиенильного катиона (рис. 3).
 Рис. 3. Образование σ-комплекса.На заключительной стадии ароматическая система восстанавливается за счёт отщепления протона с образованием целевого продукта (рис. 4).
Рис. 3. Образование σ-комплекса.На заключительной стадии ароматическая система восстанавливается за счёт отщепления протона с образованием целевого продукта (рис. 4).
 Рис. 4. Получение продукта алкилирования.При проведении реакции алкилирования ароматических соединений с использованием в качестве реагентов алкенов или спиртов катализаторами выступают минеральные кислоты. При этом образующейся электрофильной частицей является карбокатион или ионная пара, а сам механизм присоединения-отщепления SEAr ничем не отличается.
Рис. 4. Получение продукта алкилирования.При проведении реакции алкилирования ароматических соединений с использованием в качестве реагентов алкенов или спиртов катализаторами выступают минеральные кислоты. При этом образующейся электрофильной частицей является карбокатион или ионная пара, а сам механизм присоединения-отщепления SEAr ничем не отличается.
Механизм реакции ацилирования
Для проведения реакция ацилирования ароматических соединений в качестве катализаторов используются классические кислоты Льюиса, а наиболее эффективными реагентами являются хлорангидриды или ангидриды карбоновых кислот – RCOCl и (RCO)2O соответственно.
Как и при алкилировании, катализатор поляризует молекулу реагента; образующийся комплекс вступает в реакцию ароматического электрофильного присоединения-отщепления с образованием арилкетонов (рис. 5).
 Рис. 5. Ацилирование.
Рис. 5. Ацилирование.
Область применения
Реакции алкилирования и ацилирования по Фриделю – Крафтсу широко применяются для получения большого ряда ароматических промышленных продуктов, таких как этилбензол, кумол, тимол и другие, которые используются в качестве топлив, поверхностно-активных веществ, в фармацевтических препаратах и т. д. Данные соединения являются крайне важными промежуточными веществами в тонком органическом синтезе. Например, в реакциях внутримолекулярного ацилирования по Фриделю – Крафтсу ароматических 𝛾-оксокислот, получают важный класс соединений с конденсированными бензольными кольцами, таких как антрахинон.
