Стереоизомеры
Стереоизоме́ры (пространственные изомеры), химические соединения, которые имеют одну и ту же формулу и последовательность связанных друг с другом атомов, но отличаются ориентацией атомов в пространстве.
Важнейшие виды стереоизомеров – геометрические изомеры (диастереомеры) и оптические изомеры, или энантиомеры (см. Изомерия). И те и другие относятся к категории конфигурационных изомеров, отличающихся устойчивостью молекулярного скелета. По рекомендациям ИЮПАК к стереоизомерам относят также конформационные изомеры, которые, как правило, легко переходят друг в друга при вращении вокруг одинарных связей или при деформациях валентных углов, но без разрыва химических связей. Конформеры характеризуются лабильностью (нежёсткостью) молекулярного скелета и представлены главным образом ротамерами, конформациями циклических систем и атропоизомерами (рис. 1).
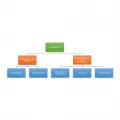 Рис. 1. Классификация стереоизомеров. Энантиомеры невозможно совместить друг с другом при наложении. При этом они являются оптическими антиподами и соотносятся как предмет и его зеркальное отражение. Например, в случае энантиомерии в двумерном пространстве молекулу монодейтерированного формальдегида и её зеркальный антипод невозможно совместить друг с другом ни при каких условиях. Для совмещения таких энантиомеров необходим выход в третье измерение. По аналогии: совмещение зеркальных изомеров модельной молекулы бромхлорфториодметана CIBrClF в трёхмерном пространстве осуществить невозможно – требуется переход к четырёхмерному пространству (рис. 2, на котором пунктиром отмечено положение зеркальной поверхности).
Рис. 1. Классификация стереоизомеров. Энантиомеры невозможно совместить друг с другом при наложении. При этом они являются оптическими антиподами и соотносятся как предмет и его зеркальное отражение. Например, в случае энантиомерии в двумерном пространстве молекулу монодейтерированного формальдегида и её зеркальный антипод невозможно совместить друг с другом ни при каких условиях. Для совмещения таких энантиомеров необходим выход в третье измерение. По аналогии: совмещение зеркальных изомеров модельной молекулы бромхлорфториодметана CIBrClF в трёхмерном пространстве осуществить невозможно – требуется переход к четырёхмерному пространству (рис. 2, на котором пунктиром отмечено положение зеркальной поверхности).
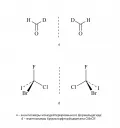 Рис. 2.Для энантиомеров чаще всего используется R,S-номенклатура, характеризующая их абсолютные конфигурации. Старшинство каждого из заместителей при асимметрическом атоме определяют в соответствии с правилами Кана – Инголда – Прелога. Для этого молекулу ориентируют так, чтобы младший заместитель был направлен в сторону от наблюдателя, и устанавливают направление падения старшинства остальных трёх заместителей. Если старшинство уменьшается по часовой стрелке, то конфигурацию асимметрического атома обозначают R (англ. right, правый), а если против часовой стрелки – то S (лат. sinister, левый) (рис. 3).
Рис. 2.Для энантиомеров чаще всего используется R,S-номенклатура, характеризующая их абсолютные конфигурации. Старшинство каждого из заместителей при асимметрическом атоме определяют в соответствии с правилами Кана – Инголда – Прелога. Для этого молекулу ориентируют так, чтобы младший заместитель был направлен в сторону от наблюдателя, и устанавливают направление падения старшинства остальных трёх заместителей. Если старшинство уменьшается по часовой стрелке, то конфигурацию асимметрического атома обозначают R (англ. right, правый), а если против часовой стрелки – то S (лат. sinister, левый) (рис. 3).
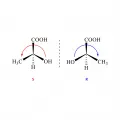 Рис. 3. Абсолютные R/S-конфигурации энантиомеров, установленные по правилам Кана – Инголда – Прелога.Энантиомерны кристаллы тартрата натрия-аммония, впервые изученные Л. Пастером в 1848 г. (рис. 4, а), отдельные формы винной и молочной кислот (рис. 4, б, в) и т. д. При смешении энантиомеров образуется оптически неактивный рацемат. Характерный пример – открытая Й. Я. Берцелиусом в 1830 г. виноградная кислота состава C4H6O6, рацемическая смесь антиподов винной кислоты (правовращающей плоскость поляризации света природной винной кислоты и левовращающей искусственной винной кислоты).
Рис. 3. Абсолютные R/S-конфигурации энантиомеров, установленные по правилам Кана – Инголда – Прелога.Энантиомерны кристаллы тартрата натрия-аммония, впервые изученные Л. Пастером в 1848 г. (рис. 4, а), отдельные формы винной и молочной кислот (рис. 4, б, в) и т. д. При смешении энантиомеров образуется оптически неактивный рацемат. Характерный пример – открытая Й. Я. Берцелиусом в 1830 г. виноградная кислота состава C4H6O6, рацемическая смесь антиподов винной кислоты (правовращающей плоскость поляризации света природной винной кислоты и левовращающей искусственной винной кислоты).
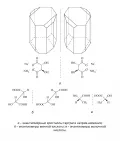 Рис. 4.Во всех рассмотренных случаях энантиомерия объясняется присутствием в молекулах стереогенных центров (асимметрических атомов углерода, окружённых четырьмя различными заместителями, как и в молекуле CIBrClF). Однако такой эффект могут обеспечивать не только атомы углерода, но, например, атомы Si, N, P, S и переходных металлов (рис. 5).
Рис. 4.Во всех рассмотренных случаях энантиомерия объясняется присутствием в молекулах стереогенных центров (асимметрических атомов углерода, окружённых четырьмя различными заместителями, как и в молекуле CIBrClF). Однако такой эффект могут обеспечивать не только атомы углерода, но, например, атомы Si, N, P, S и переходных металлов (рис. 5).
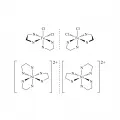 Рис. 5. Энантиомерия соединений переходных металлов: комплексы железа с хлором и этилендиамином и никеля с этилендиамином.В ахиральных средах энантиомеры проявляют одни и те же физические свойства, но вращают поляризованный свет в противоположных направлениях: один стереоизомер вращает плоскость поляризации в одну сторону, другой (зеркальный) – точно на такой же угол, но в противоположную сторону. Например, вращение стандартных растворов двух энантиомеров 2-аминобутана составляет −7,4° и +7,4° соответственно.
Рис. 5. Энантиомерия соединений переходных металлов: комплексы железа с хлором и этилендиамином и никеля с этилендиамином.В ахиральных средах энантиомеры проявляют одни и те же физические свойства, но вращают поляризованный свет в противоположных направлениях: один стереоизомер вращает плоскость поляризации в одну сторону, другой (зеркальный) – точно на такой же угол, но в противоположную сторону. Например, вращение стандартных растворов двух энантиомеров 2-аминобутана составляет −7,4° и +7,4° соответственно.
Химические свойства энантиомеров также идентичны, но только при условии, что другая реагирующая молекула является ахиральной. На рис. 6 показано взаимодействие пары энантиомеров (R и S) бромхлорфториодметана CIBrClF с одним и тем же S-энантиомером 2-хлорбутана. Для R-энантиомера CIBrClF атом брома приближается к метильной группе CH3, а атом иода приближается к этильной группе C2H5. Для S-энантиомера атом брома приближается к этильной группе хирального реагента, а атом иода приближается к его метильной группе CH3. Результаты таких разных взаимодействий также будут отличаться.
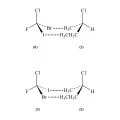 Рис. 6. Взаимодействие энантиомеров CIBrClF с одним и тем же S-энантиомером 2-хлорбутана (R/S – обозначения абсолютных конфигураций изомеров).Биологические свойства энантиомеров могут сильно отличаться. Так, левовращающий адреналин более активен, чем правовращающий; один энантиомер печально известного седативного препарата «Талидомид» (на самом деле – рацемата обоих энантиомеров) снимает тошноту и предродовое беспокойство у беременных, тогда как другой (тератоген) необратимо повреждает плод. Один из энантиомеров карвона обладает запахом тмина, другой – запахом мяты; один изомер лимонена пахнет апельсином, другой – хвоей и скипидаром; левовращающий аспарагин безвкусен, правовращающий – сладкий; природный энантиомер никотина почти втрое токсичней искусственного изомера (рис. 7).
Рис. 6. Взаимодействие энантиомеров CIBrClF с одним и тем же S-энантиомером 2-хлорбутана (R/S – обозначения абсолютных конфигураций изомеров).Биологические свойства энантиомеров могут сильно отличаться. Так, левовращающий адреналин более активен, чем правовращающий; один энантиомер печально известного седативного препарата «Талидомид» (на самом деле – рацемата обоих энантиомеров) снимает тошноту и предродовое беспокойство у беременных, тогда как другой (тератоген) необратимо повреждает плод. Один из энантиомеров карвона обладает запахом тмина, другой – запахом мяты; один изомер лимонена пахнет апельсином, другой – хвоей и скипидаром; левовращающий аспарагин безвкусен, правовращающий – сладкий; природный энантиомер никотина почти втрое токсичней искусственного изомера (рис. 7).
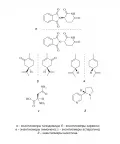 Рис. 7.Если энергетические барьеры для внутримолекулярного перехода от одной энантиомерной формы к другой малы, оптическая активность энантиомеров может не наблюдаться на практике – как, например, в стереохимически нежёстких из-за пирамидальной инверсии хиральных карбанионах, катионах оксония или во вторичных и третичных аминах (рис. 8, а). Но если заместители R1–R3 закрепить в пространстве, соединение наверняка будет разделяться на устойчивые энантиомеры – как, например, в основании Трёгера (рис. 8, б).
Рис. 7.Если энергетические барьеры для внутримолекулярного перехода от одной энантиомерной формы к другой малы, оптическая активность энантиомеров может не наблюдаться на практике – как, например, в стереохимически нежёстких из-за пирамидальной инверсии хиральных карбанионах, катионах оксония или во вторичных и третичных аминах (рис. 8, а). Но если заместители R1–R3 закрепить в пространстве, соединение наверняка будет разделяться на устойчивые энантиомеры – как, например, в основании Трёгера (рис. 8, б).
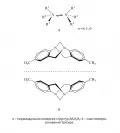 Рис. 8.В общем случае оптическая устойчивость стереоизомеров варьируется в широких пределах. Например, энантиомеры углеводов могут претерпевать ауторацемизацию с образованием равновесной смеси энантиомеров, рацемизация аминокислот происходит с участием ферментов рацемаз и т. д.
Рис. 8.В общем случае оптическая устойчивость стереоизомеров варьируется в широких пределах. Например, энантиомеры углеводов могут претерпевать ауторацемизацию с образованием равновесной смеси энантиомеров, рацемизация аминокислот происходит с участием ферментов рацемаз и т. д.
Типичный пример конформерии – внутреннее вращение в молекулах алканов. На рис. 9 показано изменение потенциальной энергии молекулы н-бутана при полном повороте вокруг связи С−С. Для образующихся при этом отдельных ротамеров рекомендованы следующие названия: A – заторможенная конформация (или антиконформация, англ. staggered); B – заслонённая конформация (эклиптическая, англ. eclipsed); C – гош-конформация (англ. gauche); D – энергетически наименее выгодная заслонённая конформация.
 Рис. 9. Изменение потенциальной энергии при внутреннем вращении в н-бутане.Конформерию циклических систем иллюстрирует стереохимически нежёсткая молекула циклогексана (Д. Бартон и О. Хассель; Нобелевская премия по химии, 1969). Для этой системы наиболее устойчива конформация А (кресло), другие (промежуточные) конформации кинетически неустойчивы и легко переходят друг в друга (рис. 10).
Рис. 9. Изменение потенциальной энергии при внутреннем вращении в н-бутане.Конформерию циклических систем иллюстрирует стереохимически нежёсткая молекула циклогексана (Д. Бартон и О. Хассель; Нобелевская премия по химии, 1969). Для этой системы наиболее устойчива конформация А (кресло), другие (промежуточные) конформации кинетически неустойчивы и легко переходят друг в друга (рис. 10).
 Рис. 10. Изменение потенциальной энергии при конформационных переходах в циклогексане.Ещё одна разновидность конформеров – атропоизомеры – появляются в результате затруднённого вращения вокруг одинарной связи. Когда заместители во фрагментах, связанных одинарной связью, ахиральны – атропоизомеры являются энантиомерами, демонстрирующими аксиальную хиральность. К конформерам можно отнести и структуры с планарной хиральностью, из которых наиболее полно изучены производные ферроцена.
Рис. 10. Изменение потенциальной энергии при конформационных переходах в циклогексане.Ещё одна разновидность конформеров – атропоизомеры – появляются в результате затруднённого вращения вокруг одинарной связи. Когда заместители во фрагментах, связанных одинарной связью, ахиральны – атропоизомеры являются энантиомерами, демонстрирующими аксиальную хиральность. К конформерам можно отнести и структуры с планарной хиральностью, из которых наиболее полно изучены производные ферроцена.
В соответствии с правилом Ле Беля – Вант-Гоффа для молекулы с n асимметрическими атомами углерода возможно максимум 2n различных стереоизомеров. Например, 4 из 6 атомов углерода в глюкозе C6H12O6 являются стереогенными, поэтому глюкоза является лишь одним из 24 = 16 возможных стереоизомеров, тогда как витамин B12 имеет уже 29 = 512 стереоизомеров (рис. 11).
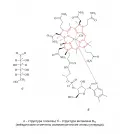 Рис. 11.Для экспериментального разделения и анализа стереоизомеров используют различия в их взаимодействии с хиральными средами, реагентами и катализаторами. Главные инструментальные методы – хиральные хроматография, спектроскопия и капиллярный электрофорез.
Рис. 11.Для экспериментального разделения и анализа стереоизомеров используют различия в их взаимодействии с хиральными средами, реагентами и катализаторами. Главные инструментальные методы – хиральные хроматография, спектроскопия и капиллярный электрофорез.
