1,2-Дихлорэтан
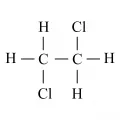
1,2-Дихлорэта́н (этилендихлорид, хлористый этилен, сим-дихлорэтан, EDC), органическое соединение, относится к хлорпроизводным углеводородов, ClCH2CH2Cl. Изомерен 1,1-дихлорэтану. Один из наиболее крупнотоннажных продуктов комплексной переработки минерального (поваренная соль) и органического сырья.
Историческая справка
1,2-Дихлорэтан – наиболее ранний из всех известных хлорированных углеводородов. Впервые синтезирован голландскими химиками И. Дейманом и П. ван Троствейком в 1795 г. путём взаимодействия этилена с хлором. Продуктом хлорирования этилена явилось маслянистое вещество, вследствие чего оно получило обиходное название «масло голландских химиков». По этой же причине этилен стал именоваться «маслородным газом», а непредельные соединения, низшим представителем которых является этилен, – олефинами (от лат. oleum – масло).
Физические свойства
Бесцветная летучая жидкость со сладковатым запахом. Молярная масса 98,96 г/моль; tкип 83,47 °C; tпл −35,36 °C. При влажности менее 0,1 % гигроскопичен. Плотность 1,2-дихлорэтана при разных температурах представлена в табл. 1.
Таблица 1. Плотность 1,2-дихлорэтана
T, °C | 0 | 15 | 20 | 30 |
ρ, кг/м3 | 1282 | 1260 | 1253 | 1238 |
Относительная плотность паров по воздуху равна 3,4; температурный коэффициент объёмного расширения 0,00117 °C −1 (в интервале 0–30 °C); теплота сгорания (пара) 1134,6 кДж/кг; теплота плавления 88,4 кДж/кг; стандартная энтальпия образования −129,7 кДж/моль; энтропия вещества в стандартном состоянии 308,82 Дж/(моль·К); дипольный момент 5,7.10−30 Кл·м (1,71 Д). Параметры критического состояния: критическое давление 5,37 МПа; критическая температура 288 °C; критическая плотность 440 кг/м3.
1,2-Дихлорэтан хорошо растворяется в спирте, эфире, нефтяных углеводородах, плохо растворяется в воде. Данные о растворимости 1,2-дихлорэтана в воде и воды в 1,2-дихлорэтане при различных температурах представлены в табл. 2.
Таблица 2. Растворимость 1,2-дихлорэтана в воде и воды в 1,2-дихлорэтане
Растворимость 1,2-С2H4Cl2 в воде | Растворимость воды в 1,2-С2H4Cl2 | ||||||
Т, °C | Растворимость, % | Т, °C | Растворимость, % | Т, °C | Растворимость, % | Т, °C | Растворимость, % |
0 10 20 25 30 | 0,91 0,84 0,87 0,86 0,86 | 40 46,5 56,5 67,5 72,5 | 0,97 1,02 1,13 1,29 1,38 | 0 10 20 25 30 | 0,09 0,11 0,16 0,19 0,22 | 40 50 57 69 | 0,26 0,34 0,35 0,52 |
1,2-Дихлорэтан склонен к образованию азеотропных смесей (табл. 3).
Таблица 3. Азеотропные смеси, образуемые 1,2-дихлорэтаном
Второй компонент | Азеотропная смесь | ||
Название | Ткип, °C | Ткип, °C | Содержание С2H4Cl2, % |
Вода | 100 80,4 64,7 87 78 | 71,6 80 60 82 71 | 91,8 15 65 61 63 |
Химические свойства
Для 1,2-дихлорэтана характерны реакции хлорирования, дегидрохлорирования, гидролиза, аммонолиза, цианирования, этерификации, алкилирования, гидрирования, окисления, взаимодействия с SO2 и Na2S.
Хлорирование.
1,2-Дихлорэтан реагирует с хлором в жидкой или паровой фазе в присутствии инициаторов с образованием 1,1,2-трихлорэтана:
Высокотемпературное хлорирование в псевдоожиженном слое катализатора приводит к образованию перхлорэтилена и тетрахлорметана:
Дегидрохлорирование.
При действии спиртовых или водных растворов щелочей от 1,2-дихлорэтана отщепляется хлороводород с образованием винилхлорида:
Термическое дегидрохлорирование 1,2-дихлорэтана при 480–500 °C приводит к образованию винилхлорида и хлороводорода:
Гидролиз.
Действие воды в присутствии кислот или щелочей при 140–250 °C и давлении до 4 МПа приводит к гидролизу 1,2-дихлорэтана с образованием этиленгликоля:
Аммонолиз.
В водных или спиртовых средах в присутствии солей аммония 1,2-дихлорэтан реагирует с аммиаком, давая этилендиамин:
Наряду с первичным амином возможно образование вторичных и третичных аминов, а также получение этиленимина.
Цианирование
При взаимодействии 1,2-дихлорэтана с цианидом натрия в спиртовой среде получается сукцинонитрил:
Этерификация.
1,2-Дихлорэтан реагирует с ацетатом натрия с образованием этиленгликольацетата:
Алкилирование.
В присутствии катализаторов Фриделя – Крафтса 1,2-дихлорэтан реагирует с бензолом и его аналогами, давая соответствующие производные:
Гидрирование.
Взаимодействие с водородом в газовой или жидкой фазе в присутствии Pd или Ni-катализаторов приводит к образованию этилена или этана в результате реакции дехлорирования:
Окисление.
При окислении 1,2-дихлорэтана воздухом образуется монохлоруксусная кислота с небольшим выходом. При окислении 1,2-дихлорэтана при 200–350 °C в присутствии катализаторов (Fe, Cu) образуются монохлорацетальдегид, хлораль, моно- и диоксид углерода в различных соотношениях.
Действие SO3.
При взаимодействии с олеумом образуется 2-хлорэтиленсульфурилхлорид:
Действие Na2S.
Полисульфид натрия реагирует с 1,2-дихлорэтаном, образуя каучукоподобные материалы – полиэтилентетрасульфиды (тиокол).
Пожароопасные и токсические свойства
1,2-Дихлорэтан – легковоспламеняющийся и токсичный продукт. Температура вспышки 13 °C в закрытом приборе и 9 °C в открытом приборе; температурные пределы воспламенения 8–31 °C; область воспламенения паров в воздухе 6,2–16,9 % (по объёму); коэффициент диффузии пара в воздухе 0,72.10−5 м2/с; порог восприятия запаха человеком 25 мг/м3; минимальное содержание О2, необходимое для диффузионного горения 17,6 % (по объёму); минимальное взрывоопасное содержание О2 при разбавлении дихлорэтановоздушной смеси диоксидом углерода 16,4 % (по объёму). Предельно допустимая концентрация (ПДК) паров в воздухе рабочей зоны производственных помещений 10 мг/м3; ПДК в атмосферном воздухе населённых мест 1 мг/м3 (среднесуточная) и 3 мг/м3 (максимальная разовая). ПДК в воде водоёмов санитарно-бытового водопользования 2 мг/л.
Получение
Методы синтеза 1,2-дихлорэтана
Синтез 1,2-дихлорэтана осуществляют несколькими методами.
Хлорирование этилена в газовой или жидкой фазе в присутствии катализатора:
Хлорирование этана в газовой фазе:
Окислительное хлорирование этана или этилена в газовой фазе на катализаторе Дикона (катализатор на основе хлорида меди), например:
Взаимодействие ацетилена с хлороводородом в присутствии диоксида азота или с хлором в присутствии тетрахлорметана в паровой фазе на смешанном катализаторе (AlCl3/NaCl/FeCl3):
Хлорирование этилхлорида хлором или другими хлорирующими агентами, например SbCl5:
Синтез из 1,2-дибромэтана и пятихлористой сурьмы:
Взаимодействие этиленгликоля с дымящей соляной кислотой, с хлоридами фосфора в присутствии хлорида цинка или с тионилхлоридом в пиридине, например:
Синтез из диазометана и хлорида цинка в эфирном растворе:
Промышленные методы производства 1,2-дихлорэтана
В промышленном масштабе 1,2-дихлорэтан получают двумя методами: прямым хлорированием этилена в жидкой фазе в присутствии катализатора хлорида железа(III) или окислительным хлорированием этилена в паровой фазе на катализаторе Дикона. Оба этих метода являются частями сбалансированной схемы производства винилхлорида.
Прямое хлорирование этилена
Существуют два основных варианта процесса: низкотемпературное хлорирование (НТХ) и высокотемпературное хлорирование (ВТХ).
При НТХ хлорирование этилена проводят в жидком 1,2-дихлорэтане, содержащем небольшие концентрации трихлорида железа в качестве катализатора. Реактор снабжён внешним охлаждающим теплообменником, поддерживающим температуру реакции ниже температуры кипения 1,2-дихлорэтана. Соотношение между хлором и этиленом приблизительно равно стехиометрическому. Для подавления образования побочных продуктов, в частности, 1,1,2-трихлорэтана, в систему добавляют небольшие количества кислорода или воздуха. Концентрация трихлорида железа обычно ниже 100 млн−1. Хлор превращается количественно с селективностью по 1,2-дихлорэтану выше 99 %. Реактор обычно изготавливают из углеродистой стали благодаря мягким условиям ведения процесса. 1,2-Дихлорэтан, полученный при НТХ, далее направляется на очистку и ректификацию.
Отличительной чертой ВТХ является то, что теплоту реакции хлорирования можно использовать для испарения и дистилляции 1,2-дихлорэтана из смеси реагентов. По существу, реактор хлорирования служит испарителем ректификационной колонны. Поскольку теплота реакции приблизительно в 6 раз выше теплоты испарения 1,2-дихлорэтана, её можно использовать также для дистилляции дополнительных количеств продукта. Таким образом, ВТХ снижает энергетические затраты процесса в целом.
ВТХ осуществляют в диапазоне температур от точки кипения 1,2-дихлорэтана при атмосферном давлении (83,47 °C) до 130 °C. Жидкая фаза состоит преимущественно из 1,2-дихлорэтана, в котором основными примесями являются другие хлорированные углеводороды С2. Часть реагирующей жидкости периодически удаляют, чтобы поддержать желаемый состав смеси. Как и при НТХ, катализатором служит хлорид железа(III), концентрация которого слабо влияет на селективность. Для хлорирования можно использовать газообразный или жидкий хлор; этилен обычно вводят в реактор в некотором избытке по отношению к хлору. Для подавления побочных реакций используют кислород или воздух. Селективность образования 1,2-дихлорэтана превышает 99 %.
Окислительное хлорирование этилена
Процесс может протекать в реакторах с псевдоожиженным или неподвижным слоем катализатора. Окисляющим агентом является концентрированный кислород или кислород воздуха. В качестве катализатора, как правило, применяют хлорид меди на различных носителях. Отвод тепла осуществляют обычно кипящей водой. Выбор катализатора псевдоожиженного слоя определяется, прежде всего, его стойкостью к истиранию, способностью к псевдоожижению в условиях процесса и селективностью. В системе с неподвижным слоем температура процесса непосредственно связана с активностью катализатора. Местные перегревы устраняют путём разбавления катализатора инертным материалом.
Эффективность использования этилена в процессе окислительного хлорирования достигает 98 %, побочные продукты – оксиды углерода, а также хлорированные органические соединения С1–С2. Дихлорэтан-сырец после промывки и осушки направляют на ректификацию.
Мировое производство 1,2-дихлорэтана составляет около 50–55 млн т в год (2023).
Применение
В 1930–1960-х гг. 1,2-дихлорэтан широко использовали как растворитель в широком спектре отраслей промышленности: лакокрасочной, кожевенной, нефтяной и газовой, текстильной, органического синтеза и др. Начиная с 1927 г. 1,2-дихлорэтан использовался в небольших количествах как фумигант. Со временем 1,2-дихлорэтан был вытеснен другими растворителями вследствие их более низкой токсичности и лучшей растворяющей способности. В 1930–1950-х гг. 1,2-дихлорэтан являлся основным исходным соединением, использовавшимся при разработке химического оружия, в частности, для синтеза иприта.
Ныне 1,2-дихлорэтан используется почти исключительно как полупродукт в органическом синтезе. Свыше 90 % полученного 1,2-дихлорэтана идёт на производство винилхлорида. В небольших количествах он используется также для получения этилендиамина, этиленгликоля, тиоколов и др. 1,2-Дихлорэтан может быть также использован для получения хлорорганических растворителей – три- и перхлорэтилена.