Растворы
Раство́ры, гомогенные (однородные) системы, состоящие из двух или более компонентов и возможных продуктов их взаимодействия. Растворы представляют собой фазы переменного состава. Различают газообразные, твёрдые и жидкие растворы. Воздух представляет собой раствор, находящийся в газообразном состоянии. Примером твёрдого раствора может служить сплав серебра с золотом, используемый ювелирами для изготовления украшений. Жидкие растворы – чай, соки, питьевая вода, бензин и многое другое.
Термин «растворы» чаще относят к жидким растворам. Вещество, которое находится при рассматриваемой температуре в том же агрегатном состоянии, что и раствор, и количественно в нём преобладает, принято называть растворителем. Если один из компонентов раствора в чистом виде при рассматриваемой температуре является жидкостью, а другой – газом или твёрдым веществом, то первый компонент называют растворителем, а второй – растворённым веществом. В зависимости от природы растворителя жидкие растворы могут быть водными и неводными (спиртовые, аммиачные и т. п.). Количество растворённого вещества, находящегося в данном количестве раствора или растворителя, называют концентрацией раствора. Наиболее часто используемые способы выражения концентрации следующие:
массовая доля ( – масса -го вещества);
мольная доля ( – количество -го вещества в молях);
моляльность – количество -го компонента в молях на 1000 г растворителя ;
молярность – количество -го компонента в молях на 1 дм3 раствора ( – объём раствора в дм3).
В зависимости от концентрации растворённого вещества растворы подразделяют на концентрированные и разбавленные.
Раствор, находящийся при данных условиях (температура, давление) в равновесии с растворённым веществом, называют насыщенным. Массу вещества, приходящегося на 100 г растворителя в насыщенном растворе, называют растворимостью. Растворимость многих веществ сильно зависит от температуры. При охлаждении водных растворов некоторые соли выделяются в виде кристаллогидратов, содержащих молекулы воды. При нагревании эти вещества постепенно теряют воду, превращаясь в безводные соли. Например, при температуре выше 45 °C из насыщенного раствора хлорида кальция кристаллизуется дигидрат CaCl2·2H2O, в интервале 30–45 °C – тетрагидрат CaCl2·4H2O, ниже 30 °C – гексагидрат CaCl2·6H2O; для получения безводной соли необходимо нагреть кристаллогидрат до 260 °C.
Задачи теории растворов – связать свойства раствора со свойствами молекул или с макроскопическими свойствами чистых компонентов. Строгое решение первой задачи возможно методами статистической физики жидкого состояния. Для этого необходимо знать потенциал парного взаимодействия молекул. Однако потенциал межмолекулярного взаимодействия известен или может быть рассчитан лишь для простых молекул. Поэтому используют модельные формы потенциала, а часто также модельные представления о структуре раствора (модели решёточная, ячеистая, свободного объёма и др.). Расчёты макроскопических свойств на основе постулируемых моделей и сравнение их с экспериментальными данными для реальных растворов позволяют выявить наиболее адекватные модели и совершенствовать теоретические представления. Термодинамическая теория растворов ставит перед собой более скромные задачи: расчёт по опытным данным термодинамических функций при изменении состава и вычисления одних термодинамических функций, если известны другие.
Для отдельного рассмотрения имеет смысл выделить растворы неэлектролитов, электролитов, полимеров и коллоидные растворы, свойства которых существенно различны. В дальнейшем теоретическом описании свойств растворов будем использовать фрагменты термодинамической теории.
Растворы неэлектролитов
В растворах неэлектролитов отсутствует электролитическая диссоциация молекул на ионы, а межмолекулярные взаимодействия в чистых жидкостях и в растворах близки по природе и интенсивности. В основе термодинамической теории растворов неэлектролитов лежит закон, сформулированный в 1887 г. Ф.-М. Раулем, – в разбавленных растворах относительное понижение давления пара растворителя над раствором равно мольной доле растворённого вещества: , где – давление насыщенного пара компонента над раствором, – давление насыщенного пара над чистым компонентом, и – мольные доли растворителя и растворённого вещества. Полученное выражение можно преобразовать к виду: . Общее давление пара над раствором равно сумме парциальных давлений и : , т. е. давление пара линейно зависит от составов растворов. В 1890 г. российский физикохимик И. Ф. Шредер предложил рассматривать растворы, подчиняющиеся закону Рауля при всех концентрациях, как некоторый стандарт. В дальнейшем такие растворы получили название идеальных (совершенных) растворов (рис. 1). Подчинение закону Рауля эквивалентно тому, что химический потенциал компонента раствора такой же, как и химический потенциал в смеси идеальных газов: , где – химический потенциал чистого -го компонента.
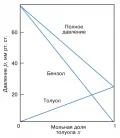 Рис. 1. Смесь двух структурно подобных жидкостей ведёт себя как идеальный раствор.С термодинамической точки зрения раствор является идеальным, если при его образовании не происходит энергетических изменений, а изменяется только энтропия компонентов на величину . На основе модельных представлений идеальный раствор можно определить как совокупность компонентов, в которой поведение каждой молекулы не зависит от состава. Для бинарного раствора это утверждение означает, что должны быть одинаковы потенциалы парного взаимодействия молекул растворителя , растворённого вещества и их взаимодействия друг с другом , поскольку в этом случае смешение жидкостей не сопровождается энергетическими изменениями. Различия в потенциалах , , будут приводить к отрицательному или положительному отклонению от закона Рауля. Например, положительные отклонения от идеальности вызывают ассоциации однородных молекул. Английский химик У. Генри экспериментально обнаружил, что в реальных растворах при низкой концентрации, когда взаимодействия практически отсутствуют, давление пара растворённого вещества также пропорционально его мольной доле (закон Генри), но коэффициент пропорциональности , получивший название константы Генри, отличен от давления пара чистого вещества: . Растворы, в которых растворённое вещество подчиняется закону Генри, а растворитель – закону Рауля, называют предельно разбавленными. На рис. 2 показаны области выполнения законов Рауля и Генри для бинарного раствора, состоящего из компонентов A и B.
Рис. 1. Смесь двух структурно подобных жидкостей ведёт себя как идеальный раствор.С термодинамической точки зрения раствор является идеальным, если при его образовании не происходит энергетических изменений, а изменяется только энтропия компонентов на величину . На основе модельных представлений идеальный раствор можно определить как совокупность компонентов, в которой поведение каждой молекулы не зависит от состава. Для бинарного раствора это утверждение означает, что должны быть одинаковы потенциалы парного взаимодействия молекул растворителя , растворённого вещества и их взаимодействия друг с другом , поскольку в этом случае смешение жидкостей не сопровождается энергетическими изменениями. Различия в потенциалах , , будут приводить к отрицательному или положительному отклонению от закона Рауля. Например, положительные отклонения от идеальности вызывают ассоциации однородных молекул. Английский химик У. Генри экспериментально обнаружил, что в реальных растворах при низкой концентрации, когда взаимодействия практически отсутствуют, давление пара растворённого вещества также пропорционально его мольной доле (закон Генри), но коэффициент пропорциональности , получивший название константы Генри, отличен от давления пара чистого вещества: . Растворы, в которых растворённое вещество подчиняется закону Генри, а растворитель – закону Рауля, называют предельно разбавленными. На рис. 2 показаны области выполнения законов Рауля и Генри для бинарного раствора, состоящего из компонентов A и B.
 Рис. 2. Изотермы давления пара в системе с положительными (I) и знакопеременными (II) отклонениями от закона Рауля.Свойства разбавленных растворов, содержащих нелетучие вещества, зависят от природы растворителя, концентрации растворённого вещества и не зависят от свойств частиц растворённого вещества. Поэтому их называют коллигативными, дословно – зависящими от количества. К ним относятся: понижение давления пара растворителя над раствором, понижение температуры замерзания раствора по сравнению с чистым растворителем, повышение температуры кипения раствора по сравнению с чистым растворителем, осмотическое давление. Причиной появления коллигативных свойств у растворов является уменьшение химического потенциала растворителя в присутствии растворённого вещества. Химический потенциал чистой жидкости равен , при добавлении второго компонента он уменьшается до , т. к. , а . На значение химического потенциала растворителя в газовой или твёрдой фазе растворённое вещество влияния не оказывает, потому что оно отсутствует в этих фазах. Из коллигативных свойств растворов можно определить молекулярную массу растворённого вещества. На рис. 3 приведена температурная зависимость химического потенциала чистого растворителя и раствора, из которой видно понижение температуры замерзания и повышение температуры кипения раствора.
Рис. 2. Изотермы давления пара в системе с положительными (I) и знакопеременными (II) отклонениями от закона Рауля.Свойства разбавленных растворов, содержащих нелетучие вещества, зависят от природы растворителя, концентрации растворённого вещества и не зависят от свойств частиц растворённого вещества. Поэтому их называют коллигативными, дословно – зависящими от количества. К ним относятся: понижение давления пара растворителя над раствором, понижение температуры замерзания раствора по сравнению с чистым растворителем, повышение температуры кипения раствора по сравнению с чистым растворителем, осмотическое давление. Причиной появления коллигативных свойств у растворов является уменьшение химического потенциала растворителя в присутствии растворённого вещества. Химический потенциал чистой жидкости равен , при добавлении второго компонента он уменьшается до , т. к. , а . На значение химического потенциала растворителя в газовой или твёрдой фазе растворённое вещество влияния не оказывает, потому что оно отсутствует в этих фазах. Из коллигативных свойств растворов можно определить молекулярную массу растворённого вещества. На рис. 3 приведена температурная зависимость химического потенциала чистого растворителя и раствора, из которой видно понижение температуры замерзания и повышение температуры кипения раствора.
 Рис. 3. Химический потенциал растворителя в присутствии растворённого вещества.Для описания свойств реальных растворов вводят понятие активности : . Если пар над раствором ведёт себя как идеальный газ, то активность можно определить через экспериментально измеряемые величины: , где – давление пара вещества над раствором – парциальное давление, – давление пара над чистым растворителем при той же температуре. Активность выражается в виде произведения мольной доли на коэффициент активности : . С учётом имеем . Отсюда следует, что значение зависит от способа выражения концентрации и выбора стандартного состояния.
Рис. 3. Химический потенциал растворителя в присутствии растворённого вещества.Для описания свойств реальных растворов вводят понятие активности : . Если пар над раствором ведёт себя как идеальный газ, то активность можно определить через экспериментально измеряемые величины: , где – давление пара вещества над раствором – парциальное давление, – давление пара над чистым растворителем при той же температуре. Активность выражается в виде произведения мольной доли на коэффициент активности : . С учётом имеем . Отсюда следует, что значение зависит от способа выражения концентрации и выбора стандартного состояния.
В симметричной системе сравнения стандартным состоянием являются чистые компоненты при температуре раствора. В асимметричной системе сравнения стандартным состоянием растворителя считается чистое вещество, а для растворённого вещества – предельно разбавленный раствор. Для него . В случае реального раствора: , – химический потенциал в стандартном состоянии, – химический потенциал идеального раствора, – избыточный химический потенциал, отражающий неидеальность раствора. В общем виде избыточную величину определяют уравнениями: . Используют также функции смешения , где – экстенсивная термодинамическая величина (например, энтальпия, энтропия, энергия Гиббса, химический потенциал и др.), второй член в уравнении выражает функцию смешения идеального раствора. Объединяя, получим: . Для важнейшей термодинамической функции – энергии Гиббса – эти функции имеют вид: (избыточная энергия Гиббса) и (энергия смешения Гиббса).
Основная задача термодинамической теории растворов – получить аналитическое выражение концентрационной зависимости коэффициента активности и избыточных функций. Среди неидеальных растворов выделяют регулярные и атермальные. Для регулярных растворов энтропия смешения совпадает с энтропией смешения идеального раствора, а единственной причиной отклонения от идеальности является наличие теплоты смешения. Коэффициенты активности зависят от температуры . Для атермальных растворов теплота смешения равна нулю, но имеется избыточная энтропия смешения. Коэффициенты активности компонентов не зависят от температуры. Регулярные и атермальные растворы представляют собой два предельных случая отклонения от идеальности и, строго говоря, в природе не существуют. Однако теория регулярных и атермальных растворов в некоторых случаях позволяет приближённо охарактеризовать термодинамические свойства конкретных неидеальных систем.
Растворы электролитов
В растворах электролитов в результате электролитической диссоциации молекул растворённого вещества образуются катионы и анионы. Растворитель обычно практически не диссоциирован. Степень диссоциации зависит от силы связи между катионами и анионами в молекуле электролита, от диэлектрической проницаемости растворителя и его способности сольватировать ионы. Вещества, содержащие ионы в исходном состоянии, называются ионофорами, или истинными электролитами; вещества, образующие ионы при растворении, называются ионогенами, или потенциальными электролитами. В молекулах ионофоров – ионная связь, ионогенов – полярная. В качестве примера приведём схему диссоциации ионогена HCl в воде: . Энергию разрыва связи H−Cl, равную 432 кДж/моль, компенсирует тепловой эффект реакции гидратации ионов. Рассмотрим диссоциацию электролита: . В силу электронейтральности раствора химический потенциал электролита связан с химическими потенциалами отдельных ионов , а , , связаны с активностями: , , . Учитывая, что электронейтральность соблюдается и в стандартном состоянии , получим: . В связи с тем что активность отдельных ионов нельзя определить из эксперимента, вводят понятие средней активности ионов – как средней геометрической из активностей ионов, составляющих исследуемый электролит: , где . Тогда имеем связь между экспериментально определяемой величиной и средней активностью: . Аналогичным образом вводят средний ионный коэффициент активности , среднюю моляльную концентрацию и среднее геометрическое стехиометрическое число образовавшихся катионов и анионов . Для равнозарядных электролитов средняя моляльность равна общей молярности.
Существует три способа выражения активности отдельного иона через произведение его концентрации на коэффициент активности с учётом шкалы концентраций: , , , где – моляльность (моль/кг растворителя); – стандартное значение моляльности, равное 1 моль/кг; – молярность (моль/дм3); – стандартное значение концентрации, равное 1 моль/дм3; – мольная доля растворённого вещества. Коэффициенты получили названия: – моляльный, – молярный, – рациональный. Используя приведённые формулы, находят соотношение средней моляльности , средней активности и активности электролита . За стандартное состояние растворителя в растворе сильного электролита выбирают чистый растворитель, а для электролита – гипотетический раствор со средней концентрацией ионов электролита, равной единице, и со свойствами предельно разбавленного раствора, у которого отсутствуют ион-ионные взаимодействия. Средние коэффициенты в разбавленном растворе электролита можно оценить при помощи правила ионной силы. Ионная сила раствора сильного электролита в смеси сильных электролитов определяется по уравнению: или , где – заряд иона. Согласно правилу ионной силы, в разбавленных растворах зависит только от ионной силы раствора и не зависит от природы других ионов, находящихся в растворе. Правило справедливо при концентрациях растворов до 0,01–0,02 моль/кг, но приближённо им можно пользоваться до 0,1–0,2 моль/кг.
Термодинамический подход указывает на специфику поведения растворов электролитов, но не может объяснить особенности этого поведения. Электростатическая теория разбавленных растворов сильных электролитов, развитая в 1923 г. П. Дебаем и Э. Хюккелем на основе модельных представлений, позволяет вычислить средний коэффициент активности электролита, эквивалентную электропроводность и теоретически обосновать правило ионной силы.
Средний коэффициент активности бинарного , -валентного электролита можно рассчитать по предельному закону Дебая – Хюккеля: , где , [(моль−1·кг)1/2/К3/2]. Существуют второе и третье приближения закона Дебая – Хюккеля, уточняющие поведение с ростом концентрации электролита.
Коллоидные растворы
К коллоидным относятся растворы, в которых растворённое вещество находится в виде частиц размером от 1 до 100 нм. Такие частицы содержат от десятков до тысяч молекул. В 1861 г. Т. Грэм обнаружил, что свойства раствора желатина, крахмала и других веществ сильно отличаются от свойств растворов неорганических соединений. При концентрировании таких растворов кристаллизация не происходит, а выделяется студнеобразная, клейковидная масса. Для коллоидов характерны слабовыраженная диффузия, низкое осмотическое давление, их растворы рассеивают свет – луч, проходящий через такой раствор, становится видимым сбоку (эффект Тиндаля). Дальнейшие исследования показали, что такими же свойствами обладают системы, образованные типичными кристаллоидами, если последние находятся в среде не в виде молекул, а в виде мельчайших (дисперсных) частиц. Так, хлорид натрия в воде образует истинный раствор, а в органических жидкостях – типичный коллоидный раствор. Поэтому следует говорить не о коллоидах и кристаллоидах, а о коллоидном (дисперсном) состоянии вещества.
Подобно тому как в истинных растворах различают растворённое вещество и растворитель, коллоидные системы рассматривают как состоящие из дисперсной фазы и дисперсионной среды. Дисперсные системы могут быть свободно- и связнодисперсными. В свободнодисперсных системах частицы обособлены и участвуют в тепловом (броуновском) движении; в связнодисперсных системах частицы сцеплены друг с другом и образуют пространственную сетку. Дисперсные системы различают по степени раздробленности дисперсной фазы. Дисперсность определяют как отношение суммарной поверхности раздела дисперсной фазы 1 с дисперсной фазой 2 к суммарному объёму частиц : . Используют также удельную поверхность – отношение суммарной поверхности раздела к общей массе частиц: . Из приведённых соотношений следует: чем меньше размер частиц , тем выше дисперсность и больше удельная поверхность. По степени дисперсности системы делят на грубодисперсные с мкм и м2/г и высокодисперсные с мкм и м2/г.
Дисперсные системы можно также классифицировать по агрегатному состоянию дисперсной фазы и дисперсионной среды. Тип дисперсной системы принято обозначать двумя буквами, первая из которых относится к дисперсной фазе, вторая – к дисперсионной среде. Буквы Т, Ж, Г обозначают твёрдое, жидкое и газообразное состояния. Системы с жидкой дисперсионной средой – обширный класс дисперсных систем. Сюда относятся разнообразные системы с твёрдой дисперсной фазой (тип Т/Ж) – золи в случае свободнодисперсных систем и гели в случае связнодисперсных систем. Протоплазма живых клеток, кровь, соки растений – всё это золи. В зависимости от размеров частиц золи одного и того же вещества могут иметь различную окраску, в отличие от истинных растворов, у которых она одинаковая. Например, золи золота могут быть зелёными, синими, фиолетовыми, вишнёвыми, рубиново-красными. Одно из важных свойств золей – наличие на поверхности частиц электрических зарядов одного знака вследствие адсорбции коллоидными частицами ионов из раствора. Для осаждения золя необходимо, чтобы его частицы соединились в более крупные агрегаты. Этот процесс называется коагуляцией, а осаждение частиц под действием силы тяжести – седиментацией. Коагуляция происходит при прибавлении к золю раствора электролита или другого золя, частицы которого имеют противоположный заряд. При определённых условиях коагуляция золей приводит к образованию гелей. В этом случае все коллоидные частицы, связывая растворитель, переходят в полужидкое-полутвёрдое состояние, способное удерживать форму. Примерами гелей являются желе, мармелад, пастила.
Системы с жидкой дисперсной фазой Ж1/Ж2 – эмульсии, с газовой дисперсной фазой Г/Ж – пены. Системы с газообразной дисперсионной средой, объединяемые общим названием аэрозоли, включают дымы, пыли (Т/Г), туманы (Ж/Г). Аэрозоль, в котором присутствуют жидкие и твёрдые частицы дисперсной фазы (Т, Ж/Г), называют смогом. Дисперсиями типа Г/Т являются разнообразные природные и искусственные пористые материалы (например, туфы, пенопласты, пенобетон).
Дисперсные системы по интенсивности взаимодействия между фазой и средой разделяют на лиофильные и лиофобные. Для лиофильных дисперсных систем характерны сильные взаимодействия на межфазной границе. Такие системы могут образовываться путём самопроизвольного диспергирования одной макрофазы в другую и поэтому являются термодинамически устойчивыми. В лиофобных системах взаимодействие между фазами слабое, для их образования требуются энергетические затраты. Лиофобные системы термодинамически неустойчивы, и их существование возможно только благодаря действию факторов стабилизации.
Применение
Растворы широко распространены в природе и играют важную роль в быту, жизнедеятельности организмов, во многих отраслях промышленности и техники. Можно сказать, что все окружающие нас жидкости – растворы, т. к. абсолютно чистых, не содержащих никаких примесей жидкостей не существует. Растворы служат средой, в которой протекают многие природные и промышленные процессы. Часто химические реакции происходят только в растворах. Изучение физико-химических свойств растворов помогает совершенствовать процессы разделения и очистки веществ методами ректификации, экстракции, кристаллизации, ионного обмена, термодиффузии и др. Использование неводных растворов связано с применением полимеров, формованием из них тонких плёнок, мембран, получением красителей и лаков. Многие минералы, горные породы, а также продукты питания (сливочное масло, молоко, мороженое), товары бытовой химии и средства личной гигиены (кремы, мази, зубные пасты) представляют собой коллоидные растворы.
