1,1-Дихлорэтан
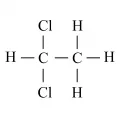
1,1-Дихлорэта́н (этилиденхлорид, несим-дихлорэтан), органическое соединение, относится к хлорпроизводным углеводородов, CH3CHCl2. Изомерен 1,2-дихлорэтану.
Физические свойства
Бесцветная, прозрачная легколетучая жидкость со сладковатым эфирным запахом. Молярная масса 98,96 г/моль; tкип 57,28 °С; tпл −96,98 °С. Плотность 1,1-дихлорэтана при разных температурах представлена в таблице 1.
Таблица 1. Плотность 1,1-дихлорэтана
T, °C | 0 | 15 | 20 | 30 |
ρ, кг/м3 | 1207 | 1184 | 1176 | 1160 |
Относительная плотность паров по воздуху 3,4; температурный коэффициент объёмного расширения 0,00107 °С−1 (в интервале 0–30 °С); теплота сгорания (жидкости) 1119,5 кДж/кг; теплота плавления 54,8 кДж/кг; стандартная энтальпия образования −129,91 кДж/моль; энтропия вещества в стандартном состоянии 304,13 Дж/(моль·К); дипольный момент 6,87.10−30 Кл·м (2,06 Д). Параметры критического состояния: критическое давление 5,065 МПа; критическая температура 250 °С; критическая плотность 420 кг/м3.
1,1-Дихлорэтан хорошо растворяется в спиртах, эфире, углеводородах, плохо – в воде. Данные о растворимости 1,1-дихлорэтана в воде и воды в 1,1-дихлорэтане при различных температурах представлены в таблице 2.
Таблица 2. Растворимость 1,1-дихлорэтана в воде и воды в 1,1-дихлорэтане
Растворимость 1,1-С2H4Cl2 в воде | Растворимость воды в 1,1-С2H4Cl2 | ||
Т, °С | Растворимость, % | Т, °С | Растворимость, % |
0 | 0,65 | 0 | 0,046 |
10 | 0,59 | 25 | 0,10 |
20 | 0,55 | 30 | 0,12 |
25 | 0,50 | ||
1,1-Дихлорэтан склонен к образованию азеотропных смесей (таблица 3).
Таблица 3. Азеотропные смеси, образуемые 1,1-дихлорэтаном
Второй компонент | Азеотропная смесь | ||
Название | Tкип, °С | Tкип, °С | Содержание 1,1-С2H4Cl2, % |
Вода | 100 | 53,3 | 98,1 |
56,2 | 56 | 70 | |
78,4 | 55 | 86 | |
Химические свойства
Для 1,1-дихлорэтана характерны реакции замещения.
При взаимодействии с хлором в жидкой или паровой фазе под действием радикальных инициаторов или света даёт смесь 1,1,1- и 1,1,2-трихлорэтана с преимущественным образованием первого:
При повышенных температурах (выше 200 °С) от 1,1-дихлорэтана в присутствии катализаторов (хлоридов металлов) отщепляется хлороводород с образованием винилхлорида:
Взаимодействие с амидом натрия, со спиртовым раствором щёлочи либо с третичными аминами приводит, в зависимости от условий реакции, к отщеплению одной или двух молекул хлороводорода с образованием винилхлорида или ацетилена:
При действии тёплого водного раствора щёлочи на 1,1-дихлорэтан образуется ацетальдегид:
Пожароопасные и токсические свойства
1,1-Дихлорэтан – легковоспламеняющаяся жидкость: температура вспышки 8,5 °С; область воспламенения паров в воздухе 4,0–14,8 % (по объёму).
Обладает наркотическими свойствами. Токсическое действие в 5 раз слабее, чем у 1,2-дихлорэтана. Предельно допустимая концентрация паров в воздухе рабочей зоны производственных помещений 10 мг/м3. Коэффициент диффузии пара в воздухе 0,77∙10−5 м2/с.
Получение
Синтез 1,1-дихлорэтана осуществляют несколькими методами.
Взаимодействие винилхлорида с хлороводородом в среде 1,1- или 1,2-дихлорэтана в присутствии катализаторов: AlCl3, FeCl3, ZnCl2. Данный метод наиболее распространён в промышленных условиях. Реакция винилхлорида с хлороводородом возможна также в среде нитробензола в присутствии AlCl3 либо в паровой фазе при повышенном давлении и температуре 100–200 °С над теми же катализаторами:
Гидрохлорирование ацетилена хлороводородом при комнатной температуре в присутствии хлоридов ртути и железа:
Хлорирование этана в паровой фазе в объёме или на катализаторе в присутствии этилена:
Взаимодействие ацетальдегида с пятихлористым фосфором:
Применение
1,1-Дихлорэтан может быть использован как растворитель для каучука, силоксановых смазок, для депарафинизации минеральных масел. В основном применяется как полупродукт для синтеза 1,1,1-трихлорэтана (метилхлороформа).