Хлор
Хлор (лат. Chlorum), Cl, химический элемент VII группы короткой формы (17-й группы длинной формы) периодической системы; относится к галогенам; атомный номер 17, атомная масса 35,453 а. е. м. В природе два стабильных нуклида 35Cl (75,78 %) и 37Cl (24,22 %); искусственно получены радионуклиды с массовыми числами 22–51, наиболее долгоживущий 36Cl (период полураспада T1/2 301 тыс. лет; β-распад и электронный захват).
Историческая справка
Газообразный хлор впервые выделен К. В. Шееле в 1774 г. окислением соляной кислоты пиролюзитом MnO2. Элементарную природу хлора установил в 1810 г. Г. Дэви и предложил в 1811 г. соответствующее окраске название «хлор» (от греч. χλωρός – жёлто-зелёный).
Распространённость в природе
Содержание хлора в земной коре 0,017 % по массе, в вулканических газах – до 1,3 %. Вследствие высокой химической активности в свободном виде не встречается. Входит в состав многих минералов. Собственные минералы хлора – в основном природные хлориды: каменная соль (галит) NaCl, сильвин KCl, карналлит KCl·MgCl2·6H2O, каинит KCl·MgSO4·3H2O, бишофит MgCl2·6H2O. Главную роль в распространении хлора в земной коре играет водная миграция. Хлор в виде иона Cl– содержится в морской воде (18,83 г/дм3), подземных рассолах, соляных озёрах и др. Ионы Cl– важны для всех живых организмов (участвуют в регулировании водного обмена и др.); в составе тканей человека 0,25 % по массе хлора (в плазме крови 0,32–0,37 %), содержание хлора в тканях растений зависит от вида растения (например, в табаке – 2,3 %, в моркови – 1,5 %, в зерновых – 0,05 %). Каменная соль (галит), природный хлорид.
Каменная соль (галит), природный хлорид.
Свойства
Конфигурация внешней электронной оболочки атома хлора 3s23р5; в соединениях проявляет степени окисления –1 (хлориды), +1 (гипохлориты), +3 (хлориты), +5 (хлораты) и +7 (перхлораты); электроотрицательность по Полингу 3,16; атомный радиус 99 пм; ионный радиус Сl– 184 пм. Молекула двухатомна, энергия диссоциации Cl2 239,24 кДж/моль.
При нормальных условиях хлор – жёлто-зелёный негорючий газ с резким удушающим запахом; tпл –100,98 °С, tкип –33,97 °С; плотность сухого газа 3,209 кг/м3 (0 °С), жидкого хлора 1558,9 кг/м3 (–33,97 °С). Хорошо растворим в неполярных жидкостях (например, TiCl4, SiCl4, SnCl4, гексане, CCl4), умеренно – в воде (образуется «хлорная вода»). При температуре ниже 9,6 °С в водных растворах образует гидраты переменного состава Cl2·nH2O (n = 6–8). Жидкий хлор – растворитель (TiCl4, SiCl4 и др.).
Хлор – один из наиболее химически активных элементов; непосредственно взаимодействует почти со всеми металлами (с некоторыми только в присутствии влаги или при нагревании) и неметаллами (реакции хлора с кислородом, азотом, инертными газами требуют специальных методов активации), образуя соответствующие хлориды. Замещает водород в насыщенных углеводородах и присоединяется к олефинам. Вытесняет бром и иод из их соединений с водородом и металлами (из соединений хлора с водородом и металлами вытесняется фтором). Смесь хлора с водородом горит при 2200 °С бесцветным или жёлто-зелёным пламенем с образованием хлороводорода (цепная реакция). Смеси хлора с водородом, содержащие 5,8–88,5 % Н2, взрывоопасны. С кислородом хлор образует ряд оксидов (наиболее важны Cl2O, ClO2, Cl2O6 и Cl2O7); все оксиды хлора нестабильны и взрывоопасны. Бинарный хлорид азота NCl3, получаемый хлорированием аммиака или солей аммония, чрезвычайно взрывчатый. С другими галогенами хлор образует межгалогенные соединения. О взаимодействии хлора с органическими веществами см. Галогенирование. Причина высокой химической активности хлора – в сравнительной лёгкости образования атомов Cl из молекул Cl2, высоком сродстве атома Cl к электрону (348,7 кДж/моль – самое высокое среди химических элементов) и высокой энергии связи хлора с большинством элементов.
Получение
Практически весь производимый хлор получают электролизом водных растворов NaCl (реже KCl); другие продукты электролиза – щёлочь (1,13 т NaOH на 1 т Cl2) и водород. Используют 3 метода электролиза: с ртутным катодом (хлор выделяется на твёрдом аноде, электродные пространства не разделены); диафрагменный (оба электрода твёрдые, анодное и катодное пространства разделены фильтрующей диафрагмой); мембранный (анодное и катодное пространства разделены катионообменной мембраной). Первые два метода существуют свыше 100 лет, третий применяют в промышленности с 1975 г. Хлор в небольших количествах получают также в качестве побочного продукта при получении натрия и магния электролизом расплавленных солей, электролизом абгазной соляной кислоты или химическим окислением хлороводорода кислородом воздуха (процесс Кел-Хлор).
Электрохимические методы получения хлора, водорода и гидроксида натрия основаны на электролитическом разложении раствора поваренной соли, протекающем по суммарной реакции:
В целях экономии электроэнергии процесс ведут при температуре электролита 85–95 °С.
Методы различаются по реакциям, протекающим на катоде и в прикатодном пространстве и по способам разделения продуктов электролиза.
Анодный процесс по всем методам одинаков и сводится к выделению хлора на аноде по реакции:
В электролизёре с ртутным катодом на катоде происходит разряд ионов натрия с образованием жидкого сплава – амальгамы натрия:
Амальгама натрия в отдельном аппарате (разлагателе) при взаимодействии с водой образует водород и гидроксид натрия:
Регенерированная ртуть из разлагателя возвращается в электролизёр. При получении щёлочи в разлагатель подают обессоленную воду, что позволяет получать раствор гидроксида натрия высокой степени чистоты.
 Принципиальная схема электролизёра с ртутным катодом.В диафрагменных и мембранных электролизёрах на катоде выделяется водород, а в прикатодном пространстве образуется раствор гидроксида натрия:
Принципиальная схема электролизёра с ртутным катодом.В диафрагменных и мембранных электролизёрах на катоде выделяется водород, а в прикатодном пространстве образуется раствор гидроксида натрия:
Различие в методах заключается в способе разделения продуктов электролиза. В диафрагменном методе анодная и катодная камеры разделены фильтрующей диафрагмой. Для предотвращения переноса ионов гидроксида в анодную камеру через диафрагму под действием электрического поля создают проток электролита через диафрагму из анодной камеры в катодную. Вследствие этого в католите всегда присутствует хлорид натрия, а концентрация гидроксида натрия не превышает 10–11 %.
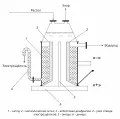 Принципиальная схема электролизёра с вертикальной фильтрующей диафрагмой.В мембранном методе анодная и катодная камеры разделяются непроточной катионо-обменной мембраной, проницаемой для катионов натрия и непроницаемой для анионов гидроксида и хлора. Современные катионообменные мембраны позволяют получать раствор гидроксида натрия с концентрацией 32–35 %. Для получения раствора щёлочи такого состава в катодную камеру при электролизе добавляют обессоленную воду, что позволяет получать раствор гидроксида натрия высокой степени чистоты.
Принципиальная схема электролизёра с вертикальной фильтрующей диафрагмой.В мембранном методе анодная и катодная камеры разделяются непроточной катионо-обменной мембраной, проницаемой для катионов натрия и непроницаемой для анионов гидроксида и хлора. Современные катионообменные мембраны позволяют получать раствор гидроксида натрия с концентрацией 32–35 %. Для получения раствора щёлочи такого состава в катодную камеру при электролизе добавляют обессоленную воду, что позволяет получать раствор гидроксида натрия высокой степени чистоты.
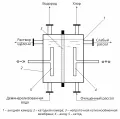 Принципиальная схема устройства мембранного электролизёра.Катионообменные мембраны, пропускающие лишь ионы Na+ и К+, изготовляются на основе фторполимерных смол с активными сульфо- и карбоксильными группами общей формулы R–SО3Н и R–СООН (срок службы – до 5 лет). Они обладают высокой химической стойкостью и высокой селективностью.
Принципиальная схема устройства мембранного электролизёра.Катионообменные мембраны, пропускающие лишь ионы Na+ и К+, изготовляются на основе фторполимерных смол с активными сульфо- и карбоксильными группами общей формулы R–SО3Н и R–СООН (срок службы – до 5 лет). Они обладают высокой химической стойкостью и высокой селективностью.
Мембранные электролизёры необходимо эксплуатировать при максимально возможной плотности тока, которая составляет 3–6 кА/м2. За счёт применения активированных анодов и катодов с низким перенапряжением для выделения хлора и водорода, использования высокоэффективных мембран с малым электросопротивлением, минимально возможного межэлектродного расстояния, напряжение на электролизёрах составляет 3,05–3,10 В, а расход электроэнергии на 1 т гидроксида натрия порядка 2000–2100 кВт·ч, что ниже, чем в диафрагменных электролизёрах при существенно меньших плотностях тока.
Благодаря использованию высоких плотностей тока мембранные электролизёры компактнее диафрагменных и требуют для своего размещения меньших производственных площадей.
Мембранный метод позволяет достичь выхода по току 95–97 % при концентрации щёлочи 32–35 %, экологически менее опасен, требует меньшего расхода энергии и меньших капиталовложений по сравнению с другими методами, поэтому доля хлора, получаемого этим методом, непрерывно возрастает – по состоянию на 2023 г. свыше 70 % производств хлора в мире используют мембранную технологию. Материал мембран, пропускающих лишь ионы Na+ и K+, – как правило, фторсодержащие полимеры (срок службы – до 5 лет). Мировое производство хлора 68–70 млн т/год (2023).
Применение
Хлор используют для производства окислительно-отбеливающих веществ – кальция гипохлорита, натрия гипохлорита, хлорной извести, хлоридов многих элементов, ряда хлорорганических продуктов (поливинилхлорида, хлоропренового каучука, дихлорэтана, перхлорэтилена, хлороформа, эпихлоргидрина и др.), для водоочистки. В мире на производство хлорсодержащих органических продуктов расходуется 60–75 % производимого хлора, неорганических – 10–15 %, в целлюлозно-бумажной промышленности – 5–15 %.
Токсичен, раздражает слизистые оболочки, дыхательные пути и лёгкие. Хлор – первое боевое отравляющее вещество, использованное во время Первой мировой войны (см. в статье Ипр).
