Винилхлорид
Винилхлори́д [хлористый винил, хлорвинил, хлорэтилен, хлорэтен, этиленхлорид, общепринятая в мире аббревиатура – VCM (vinyl chloride monomer)], органическое вещество, простейшее хлорпроизводное этилена, C2H3Cl, молярная масса 62,499 г/моль. Наиболее крупнотоннажный продукт комплексной переработки минерального (поваренная соль) и органического сырья.
Историческая справка
Впервые винилхлорид был получен немецким химиком Портрет Юстуса фон Либиха.
Австрийская национальная библиотека, Вена. Ю. фон Либихом и его учеником − французским химиком А. В. Реньо в 1835 г. действием спиртового раствора едкого калия на 1,2-дихлорэтан. Одновременно А. В. Реньо обнаружил способность винилхлорида полимеризоваться под действием света, но не придал этому значения ввиду инертности образовавшегося соединения к действию различных химических реагентов. В 1858 г. Ш. А. Вюрц и Э. Франкленд синтезировали винилхлорид действием этилата натрия на 1,2-дихлорэтан.
Портрет Юстуса фон Либиха.
Австрийская национальная библиотека, Вена. Ю. фон Либихом и его учеником − французским химиком А. В. Реньо в 1835 г. действием спиртового раствора едкого калия на 1,2-дихлорэтан. Одновременно А. В. Реньо обнаружил способность винилхлорида полимеризоваться под действием света, но не придал этому значения ввиду инертности образовавшегося соединения к действию различных химических реагентов. В 1858 г. Ш. А. Вюрц и Э. Франкленд синтезировали винилхлорид действием этилата натрия на 1,2-дихлорэтан.  Анри-Виктор Реньо.В 1902 г. Э. Билтц получил винилхлорид каталитическим разложением 1,2-дихлорэтана на пемзе при температуре красного каления, а в 1908 г. Ж.-Б. Сандеран получил винилхлорид, разлагая 1,2-дихлорэтан на обезвоженном глинозёме, при температуре 370 °C.
Анри-Виктор Реньо.В 1902 г. Э. Билтц получил винилхлорид каталитическим разложением 1,2-дихлорэтана на пемзе при температуре красного каления, а в 1908 г. Ж.-Б. Сандеран получил винилхлорид, разлагая 1,2-дихлорэтан на обезвоженном глинозёме, при температуре 370 °C.
Однако предпосылками промышленного осуществления производства винилхлорида явились открытые практически одновременно в 1912–1913 гг. реакции получения винилхлорида методом гидрохлорирования ацетилена в газовой и жидкой фазе (Ф. Клатте, Германия) и его фотополимеризации (И. И. Остромысленский, Россия). Первое промышленное производство винилхлорида методом гидрохлорирования ацетилена создано в 1929 г. в г. Райнфельден (Германия).
 Химический завод конгломерата IG Farben (ныне Evonik Industries), на котором в 1929 начали производство винилхлорида. Райнфельден (Германия).
Химический завод конгломерата IG Farben (ныне Evonik Industries), на котором в 1929 начали производство винилхлорида. Райнфельден (Германия).
Строение молекулы
В молекуле винилхлорида связь C−Cl более короткая и более прочная, чем аналогичная связь в молекуле хлорэтана, что связано с p,π-сопряжением π-орбиталей кратной связи с неподелённой электронной парой атома хлора.
В таблице представлены сравнительные значения длин и энергии связей (C−Hal), а также дипольных моментов в молекуле винилхлорида и некоторых хлоралканов.
Сравнительные значения длин и энергии связей
Соединение | Энергия связи C−Cl, | Длина связи C−Cl, нм | Дипольный момент [молекулы], 10−30 Кл·м |
CH2=CHCl | 374,89 | 0,169 | 4,80 |
CH3−CH2Cl | 336,39 | 0,179 | 6,66 |
CH3Cl | 349,78 | 0,176 | 6,19 |
Смещение электронной плотности в молекуле винилхлорида от атома хлора в сторону двойной связи благодаря эффекту сопряжения (+M-эффект) действует одновременно с сильным электроноакцепторным индуктивным эффектом атома хлора (−I-эффект), однако влияние последнего сильнее (−I > +M), поэтому галоген несёт на себе небольшой отрицательный заряд.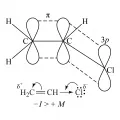 Условная молекулярная структура винилхлорида.
Условная молекулярная структура винилхлорида.
Физические свойства
Винилхлорид представляет собой бесцветный газ со слабым сладковатым запахом; плотность жидкости при –20 °C – 983 кг/м3 и при 20 °C – 911 кг/м3; плотность относительная по воздуху 2,17; tпл −153,8 °C, tкип −13,8 °C; температурный коэффициент объёмного расширения 0,0022 °С−1 (в интервале от −13 до 28 °С); давление паров 0,337 Мпа (при 20 °С). Параметры критического состояния: критическое давление 5,34 МПа, критическая температура 158,4 °С; теплота плавления 4744 кДж/моль; теплота сгорания 1198,1 кДж/моль, теплота полимеризации 92,11 кДж/моль, теплота образования стандартная 37,26 кДж/моль, энтропия вещества в стандартном состоянии 263,96 Дж/(моль · К). Дипольный момент 4,84 · 10−30 Кл · м (1,45 ± 2 % D), диэлектрическая проницаемость 6,26 при 25 °C.
Хорошо растворяется в 1,2-дихлорэтане, хлороформе, эфире, ряде других органических растворителей. Это свойство широко используется для извлечения винилхлорида из разбавленных газовых смесей.
Малорастворим в воде: при 20 °C растворяется 0,25 %, а при 25 °C – 0,11 %. Растворимость воды в винилхлориде при 20 °C – 0,097 %, при 30 °C – 0,124 %.
Химические свойства
Винилхлорид – активное химическое соединение, чьи химические свойства определяются наличием как двойной связи, так и атома хлора.
Подобно алкенам, винилхлорид вступает в реакции присоединения по кратной связи, при этом атом хлора выступает в роли электроноакцепторного заместителя, тем самым снижая реакционную способность соединения при электрофильном присоединении и повышая её при нуклеофильном.
Атом хлора в винилхлориде очень инертен, что связано с влиянием двойной связи, поэтому реакции замещения, связанные с ним, для винилхлорида нехарактерны. В то же время именно инертность позволяет относительно легко отщеплять от него молекулу хлороводорода.
По двойной связи легко вступает в реакции полимеризации, окисления, гидрирования, галоидирования, гидрогалоидирования, гипогалоидирования, теломеризации, присоединяет нитрозилхлорид, нитрилхлорид, сульфурилхлорид, тионилхлорид.
Термически устойчив: заметное разложение начинается лишь при температурах выше 550 °C, с образованием ацетилена, хлоропрена, винилацетилена, хлороводорода.
Для химической промышленности первостепенное значение имеет реакция полимеризации, лежащая в основе крупнотоннажного синтеза поливинилхлорида и его сополимеров.
Методы синтеза винилхлорида
Реакция дегидрохлорирования
Винилхлорид получается путём отщепления хлористого водорода от 1,2-дихлорэтана.
Дегидрохлорирование может проводиться в жидкой фазе с помощью водного или спиртового раствора щёлочи:
Реакция дегидрохлорирования может проводиться и в паровой фазе при температуре 300−500 °C, в присутствии катализаторов, инициаторов или без них:
Реакция гидрохлорирования
Винилхлорид получается в результате реакции гидрохлорирования ацетилена. Гидрохлорирование может быть осуществлено как в паровой, так и жидкой фазе, в присутствии катализаторов – хлорида ртути, хлоридов меди и др.:
Реакция хлорирования
Винилхлорид может получаться путём хлорирования этилена или этана в объёме или на катализаторе, при температуре 450−550 °C:
Селективность, особенно при хлорировании этана, невысока.
Реакция оксихлорирования
Винилхлорид может получаться окислительным хлорированием этилена или этана в паровой фазе, при температуре 450−550 °C, на катализаторе CuCl2 / носитель (катализатор Дикона):
Реакция дехлорирования
Винилхлорид можно получать из 1,1,2-трихлорэтана взаимодействием с цинком, железом или алюминием, в присутствии водяного пара:
Реакция диспропорционирования
Винилхлорид может быть получен в результате реакции диспропорционирования ацетилена и 1,2-дихлорэтана:
Синтез из этилена и 1,2-дихлорэтана
Винилхлорид можно получить путём синтеза из этилена и 1,2-дихлорэтана в паровой фазе над безводным сульфатом кальция:
Промышленные методы производства винилхлорида
По состоянию на 2023 г. в мире существуют два основных промышленных метода производства винилхлорида: гидрохлорирование ацетилена; сбалансированный по хлору процесс на основе этилена.
Гидрохлорирование ацетилена
Промышленная технология гидрохлорирования ацетилена основана на газофазном каталитическом процессе, в котором в качестве исходных реагентов используют синтетический или абгазный хлороводород, а также карбидный или пиролизный ацетилен:
Метод характеризуется высокой, близкой к 100 %, конверсией реагентов, высокой селективностью – более 98 %, простой технологической схемой и, как следствие, низкими капитальными вложениями. К недостаткам относятся использование относительно дорогого ацетилена, низкая единичная мощность реакторов, а также экологические проблемы, связанные с применением дихлорида ртути (сулемы).
 Блок-схема промышленного процесса гидрохлорирования ацетилена.
Блок-схема промышленного процесса гидрохлорирования ацетилена.
Сбалансированный по хлору процесс на основе этилена
Сбалансированный процесс на основе этилена включает три основные реакционные стадии:
прямое жидкофазное хлорирование этилена с получением 1,2-дихлорэтана по реакции:
газофазное каталитическое окислительное хлорирование этилена с получением 1,2-дихлорэтана по реакции:
термический пиролиз 1,2-дихлорэтана с получением винилхлорида по реакции:
Суммарно:Наличие стадии прямого хлорирования этилена с получением дополнительного количества дихлорэтана необходимо для того, чтобы обеспечить стадию оксихлорирования нужным количеством хлористого водорода (на образование 1 моля дихлорэтана на стадии расходуется 2 моля HCl).
Эффективность использования сырья (этилена и хлора) в сбалансированном процессе превышает 97 %, отходы производства (25–30 кг на тонну продукта) подвергаются термообезвреживанию.
Преимуществами сбалансированного процесса являются:
использование в качестве органического сырья относительно дешёвого этилена;
возможность использования реакторных узлов большой единичной мощности (200–300 тыс. т в год) и создания производств мощностью 400–600 тыс. т в год;
реализация эффективных технологий утилизации отходов и очистки сточных вод.
 Блок-схема сбалансированного метода получения винилхлорида из этилена.Сбалансированный метод позволяет достичь значений эффективности использования сырья 97–98 %, экологически менее опасен, требует меньшего удельного расхода энергии и меньших удельных капиталовложений по сравнению с другими методами, поэтому доля новых производств винилхлорида, получаемого этим методом, непрерывно возрастает: по состоянию на 2023 г. свыше 60 % производств винилхлорида в мире используют сбалансированную по хлору технологию. Мировое производство винилхлорида 48–50 млн т/год (2023).
Блок-схема сбалансированного метода получения винилхлорида из этилена.Сбалансированный метод позволяет достичь значений эффективности использования сырья 97–98 %, экологически менее опасен, требует меньшего удельного расхода энергии и меньших удельных капиталовложений по сравнению с другими методами, поэтому доля новых производств винилхлорида, получаемого этим методом, непрерывно возрастает: по состоянию на 2023 г. свыше 60 % производств винилхлорида в мире используют сбалансированную по хлору технологию. Мировое производство винилхлорида 48–50 млн т/год (2023).
Другие промышленные методы производства винилхлорида
Щелочное омыление 1,2-дихлорэтана
Метод, основанный на реакции дегидрохлорирования 1,2-дихлорэтана в жидкой фазе с использованием щелочных агентов. Метод характеризуется простотой технологической схемы, что определило широкие масштабы его применения в 1940–1950-х гг. К началу 1960-х гг. метод потерял своё значение в промышленности из-за большого расхода гидроксида натрия и низкого показателя полезного использования хлора.
Комбинированный метод на основе этилена и ацетилена
В данной технологии в состав производства винилхлорида включена стадия термического пиролиза нафты (лигроина) с получением смеси разбавленных (8–9 %) ацетилена и этилена примерно в стехиометрическом соотношении. Эта смесь, без концентрирования и разделения, подвергается сначала гидрохлорированию с превращением ацетилена в винилхлорид, а оставшийся этилен хлорируют до 1,2-дихлорэтана, пиролизуемого до винилхлорида и хлороводорода, который возвращается на стадию гидрохлорирования ацетилена.
Химизм процесса:
Метод позволил заменить половину ацетилена на более дешёвый этилен, а также утилизировать хлороводород, тем самым доведя почти до 100 % полезное использование хлора.
Технология была достаточно распространена в 1960–1970-х гг. К 21 в. потеряла практическое значение, хотя отдельные производства продолжают эксплуатироваться в промышленных масштабах.
Окислительное хлорирование этана
Процесс протекает при температурах 500–550 °C на катализаторах, содержащих хлорид меди, по суммарной реакции:
Пик исследований пришёлся на 1970–1980-е гг., однако в связи с жёсткими условиями эксплуатации, невысоким выходом целевого продукта и значительным количеством отходов процесс так и не был реализован в промышленных масштабах.
Применение
Винилхлорид используют в первую очередь (97–98 %) для производства поливинилхлорида, в том числе суспензионного (более 80 %), эмульсионного, микросуспензионного. Около 1 % выпускаемого винилхлорида применяют для получения сополимеров с винилацетатом, винилиденхлоридом. До 1 % винилхлорида используют в качестве полупродукта для получения винилиденхлорида, хлорацетальдегида, 1,1,1-трихлорэтана (метилхлороформа).
Безопасность
Винилхлорид является чрезвычайно огне- и взрывоопасным, при горении выделяет токсичные вещества: оксид углерода, хлороводород, фосген. Температура вспышки в закрытом приборе −61,1 °C, в открытом −77,8 °C, температура самовоспламенения 472 °C; температурные пределы взрываемости паров в воздухе ниже −45 °C; область воспламенения паров в воздухе 3,6–33,0 % об., в кислороде 4–70 % об.
Винилхлорид – сильный яд, оказывающий на человека канцерогенное, мутагенное и тератогенное действие. Предельно допустимая концентрация паров в воздухе рабочей зоны производственных помещений 1 мг/м3 (Россия).