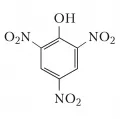
Тринитрофенол
Тринитрофено́л (2,4,6-тринитрофенол, пикриновая кислота), ароматическое соединение, нитропроизводное фенола, (NO2)3C6H2OH. Соли называются пикратами. Впервые пикриновая кислота получена в 1771 г. П. Вульфом при действии азотной кислоты на индиго. Молярная масса 229,11 г/моль. Плотность 1,763 г/см3. Температура плавления 122,5 °C. Разлагается при нагревании до 300 °C.
Физико-химические свойства
Тринитрофенол – кристаллическое вещество от бесцветного до жёлтого цвета, растворимое в воде [1,4 г/100 мл (20 °C), 6,8 г/100 мл (100 °C)], этаноле (4,91 г/100 мл), диэтиловом эфире (1,43 г/100 мл), бензоле, метаноле, пиридине, серной кислоте, уксусной кислоте, ацетоне, нитробензоле.
Тринитрофенол – сильная кислота, константа диссоциации кислоты (pKa) составляет 0,4.
Тринитрофенол проявляет химические свойства фенолов и ароматических соединений. Он образует соли с металлами, аммиаком и органическими основаниями (аминами, гидразинами и др.). С ароматическими углеводородами образует твёрдые хорошо кристаллизующиеся соединения – комплексы с переносом заряда. По гидроксильной (–OH) группе тринитрофенол образует простые и сложные эфиры. Под действием хлорида фосфора(V) или оксихлорида фосфора в присутствии третичных аминов или диметилформамида превращается в 1,3,5-тринитро-2-хлорбензол (пикрилхлорид). При восстановлении в мягких условиях (например, под действием глюкозы в щелочном растворе или сульфида натрия) тринитрофенол превращается в 2-амино-4,6-динитрофенол (пикраминовую кислоту), при более глубоком восстановлении – в триаминофенол. Гипохлоритами в присутствии воды тринитрофенол окисляется до хлорпикрина, персульфатом аммония – до углекислого газа, синильной и азотной кислот.
Качественной реакцией на тринитрофенол является взаимодействие с цианидом калия, приводящее к образованию ярко-красного соединения – изопурпуровой кислоты.
Тринитрофенол взрывается при детонации, в контакте с металлами и их оксидами, при ударе, трении, нагревании; теплота взрыва 4397 кДж/моль, скорость детонации 7480 м/с (для образца плотностью 1,77 г/см3), температура вспышки 300–310 °C (в начале 20 в. применялся как бризантное взрывчатое вещество).
Тринитрофенол является токсичным веществом.
Способы получения
Тринитрофенол получают сульфированием фенола с последующим нитрованием n-фенолсульфокислоты; омылением 2,4-динитрохлорбензола в 2,4-динитрофенол с последующим нитрованием; окислительным нитрованием бензола.
Применение
Тринитрофенол – сырьё для синтеза хлорпикрина (нитротрихлорметан) и пикраминовой кислоты (2-амино-4,6-динитрофенол) – промежуточных веществ в синтезе красителей. Он применяется в аналитической химии: служит цветным индикатором для колориметрического определения белков и аминокислот, а также используется для выделения и идентификации органических веществ.