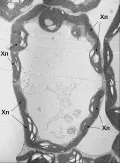
Хлоропласты
Хлоропла́сты (от греч. χλωρός – зелёный и πλαστός – вылепленный), одна из разновидностей пластид – органелл, характерных для клеток фотосинтезирующих водорослей и растений. Хлоропласты имеют зелёный цвет из-за присутствия пигментов – хлорофиллов. У бурых и красных водорослей зелёный цвет хлорофиллов маскируется наличием других пигментов. Основная функция хлоропластов – поглощение и трансформация энергии света в процессе фотосинтеза. Химический состав хлоропластов (% на сухую массу): белки – 35–55; липиды – 20–30; углеводы – 10; рибонуклеиновые кислоты (РНК) – 2–3; дезоксирибонуклеиновые кислоты (ДНК) – 0,5; хлорофилл – 9; каротиноиды – 4,5.
Хлоропластам принадлежит несколько мировых рекордов в биологии: они содержат самый распространённый белок – рибулозо-1,5-бисфосфаткарбоксилаза/оксигеназа (РуБисКо), самый распространённый пигмент – хлорофилл и самый распространённый липид – моногалактозилдиацилглицерин (МГДГ).
История открытия
Микроскопические исследования хлоропластов начались в 1678 г., когда А. ван Левенгук, торговец тканями и изготовитель линз для микроскопов, сообщил Лондонскому королевскому обществу, что увидел зелёные глобулы в клетках листьев. В 1837 г. немецкий ботаник Х. фон Моль опубликовал работу, в которой впервые сделал подробное описание хлоропластов, назвав их «зерно хлорофилла». В 1848 г. австрийский естествоиспытатель Ф. Унгер определил хлоропласты как клеточные структуры, связанные с пигментом. В 1865 г. немецкий учёный Ю. фон Сакс установил, что на свету в листьях образуется крахмал, который локализован в хлоропластах. В 1881 г. немецкий физиолог Т. Энгельман экспериментально доказал, что кислород образуется в хлоропластах. В 1885 г. немецкий эколог А. Шимпер описал хлоропласты как клеточные компоненты, содержащие хлорофилл или другие пигменты, которые развиваются из бесцветных предшественников и способны делиться.
До середины 1930-х гг. считалось, что граны являются артефактами фиксации (коагуляции), а хлоропласты имеют гомогенную внутреннюю часть. Только после изобретения электронного микроскопа (1931) удалось изучить ультраструктурную организацию хлоропластов.
Морфология
Форма и размер хлоропластов варьируют в клетках у разных видов высших растений, но в пределах одной ткани относительно постоянны. Чаще всего хлоропласты имеют форму двояковыпуклой линзы длиной 3–10 мкм, шириной 2–4 мкм, толщиной 2–5 мкм. Количество хлоропластов в клетках зависит от вида растений и варьирует от 15 до 50 шт. С увеличением размера клетки число хлоропластов возрастает (в результате деления и образования из пропластид), и наоборот, при избытке их количество уменьшается (в результате дегенерации).
Клетки водорослей часто содержат один крупный хлоропласт (хроматофор), его морфология более разнообразна (звёздчатая, сетчатая, чашевидная, спиралевидная), чем у растений.
Листья светолюбивых растений имеют более мелкие хлоропласты, чем листья теневыносливых. В клетке хлоропласты чаще всего локализуются около ядра или клеточной стенки.
Подвижность
Хлоропласты способны перемещаться в клетке активно (за счёт белков актинов) либо пассивно (вместе с цитозолем). На их распределение (ориентацию) в клетке влияет интенсивность освещения. Хлоропласты собираются в местах со слабой освещённостью (положительный фототаксис) и избегают мест с сильной освещённостью (отрицательный фототаксис). У высших растений перемещение хлоропластов регулируется фоторецепторами синего света – фототропинами, тогда как у низших растений и папоротников происходит дополнительное восприятие света неохромом, поглощающим красный свет. Движение хлоропластов важно для выживания растений при ярком свете и для эффективного фотосинтеза при слабом освещении.
Ультраструктурная организация хлоропластов высших растений
Внутреннее содержимое хлоропластов (строма) отграничена от цитоплазмы оболочкой, состоящей их двух различных по свойствам мембран – внешней и внутренней, которые никогда не сливаются друг с другом, как это показано на микрофотографиях в работе Попова В.Н. и Астаховой Н.В. Изменение ультраструктуры хлоропластов Cucumis sativus L. и Secale cereale L. при низкотемпературном закаливании (2021). Внешняя мембрана проницаема для большинства неорганических и органических молекул, содержит рецепторы и селективные потенциалзависимые каналы, через которые из цитоплазмы поступают ионы, аминокислоты, амины, пептиды, триозофосфаты и др. Внутренняя мембрана оболочки обладает избирательной проницаемостью и содержит специальные транслокаторы, пересекающие обе мембраны и необходимые для переноса продуктов фотосинтеза в цитозоль. Транспорт крупных молекул, например пептидов, через оболочку хлоропластов обеспечивается двумя гетероолигомерными белковыми комплексами, называемыми TOC (транслокон на внешней мембране хлоропластов) и TIC (транслокон на внутренней мембране хлоропластов). На внутренней мембране локализованы ферменты, участвующие в синтезе липидов мембран тилакоидов.
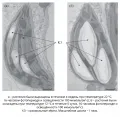 Электронные микрофотографии среза хлоропластов листа огурца (Cucumis sativus L.). Из статьи: Попов В., Астахова Н. Изменение ультраструктуры хлоропластов Cucumis sativus L. и Secale cereale L. при низкотемпературном закаливании // Физиология растений. 2021. Т. 68, № 4. С. 406.Строма представлена бесцветным гидрофильным матриксом, в который погружены ферменты темновой фазы фотосинтеза, синтеза фотосинтетических пигментов, полярных липидов мембран, белков мембран тилакоидов, большой субъединицы РуБисКО, а также рибосомы, ДНК, РНК, неорганические ионы, зёрна крахмала и др.
Электронные микрофотографии среза хлоропластов листа огурца (Cucumis sativus L.). Из статьи: Попов В., Астахова Н. Изменение ультраструктуры хлоропластов Cucumis sativus L. и Secale cereale L. при низкотемпературном закаливании // Физиология растений. 2021. Т. 68, № 4. С. 406.Строма представлена бесцветным гидрофильным матриксом, в который погружены ферменты темновой фазы фотосинтеза, синтеза фотосинтетических пигментов, полярных липидов мембран, белков мембран тилакоидов, большой субъединицы РуБисКО, а также рибосомы, ДНК, РНК, неорганические ионы, зёрна крахмала и др.
Строма пронизана специализированной мембранной системой – тилакоидами. Тилакоиды содержат мембранно-белковые комплексы, которые участвуют в световых реакциях фотосинтеза. Собранные в стопки тилакоиды образуют граны. Хлоропласты, имеющие граны, относят к гранальному типу, а те, в которых есть только тилакоиды стромы – к агранальному типу. У цианобактерий и большинства водорослей тилакоиды не образуют граны, а организованы слоями, часто параллельными контуру клеток.
Тилакоиды формируют единую мембранную систему, разделяют тем самым хлоропласт на два компартмента: строму и люмен (внутритилакоидное пространство), благодаря чему быстрые (светозависимые) реакции протекают отдельно от более медленных химических процессов (восстановление углерода). Третьим компартментом хлоропласта часто считают межмембранное пространство между внешней и внутренней мембранами оболочки.
На срезе хлоропластов часто можно увидеть сферические пузырьки – пластоглобулы, которые содержат пластид-специфические липиды, витамины, пластохинон, белки, пигменты и др. Пластоглобулы связаны с мембраной тилакоидов стромы с помощью липидного монослоя. Их количество зависит от стадии развития хлоропласта и наличия неблагоприятных факторов внешней среды. Благодаря пластоглобулам обеспечивается быстрая (без биосинтеза липидов) адаптация тилакоидных мембран к изменяющимся условиям среды.
В хлоропластах некоторых эукариотических водорослей можно встретить сферические включения белковой природы – пиреноиды, вокруг которых откладывается крахмал.
Функции
Основная функция хлоропластов – осуществление процесса фотосинтеза. В тилакоидные мембраны встроены молекулы фотосинтетических пигментов: хлорофиллов и каротиноидов. На мембранах тилакоидов протекают световые (светозависимые) реакции фотосинтеза, тогда как в строме, – реакции фотосинтетической ассимиляции углерода (темновая фаза фотосинтеза). Другие функции хлоропластов связаны с синтезом жирных кислот, аминокислот, фитогормонов, витаминов, нуклеотидов, вторичных метаболитов (терпеноиды), ассимиляционного крахмала, ферментов, участвующих в световой реакции фотосинтеза, а также белков мембран тилакоидов. Хлоропласты отвечают за восстановление нитритов и сульфатов и превращение их в органические соединения.
Полуавтономность
Наличие собственного генетического аппарата (пластом) и белок-синтезирующей системы обусловливают некоторую полуавтономность хлоропластов, т. е. они являются частично независящими от функционирования ядра органеллами.
Геном хлоропластов локализован в особой области – нуклеотиде, представляющим собой комплекс, состоящий из ДНК, РНК и белков. Молекула ДНК хлоропластов, как и у бактерий, не окружена мембраной, не связана с гистонами, имеет размер 120–220 т. п. н. ДНК хлоропластов содержит интроны и имеет кольцевую, линейную или многоразветвлённую структуру. Количество генов, кодируемых ДНК хлоропластов, может достигать 315. Хлоропластный геном был впервые секвенирован в 1986 г. у растений табака (Nicotiana tabacum) и печёночника (Marchantia polymorpha). В базе данных генома органелл Национального центра биотехнологической информации (National Center for Biotechnology Information, NCBI) доступны сведения о хлоропластной ДНК почти 4 тыс. видов растений и водорослей.
В ходе эволюции многие гены из хлоропластного генома были перенесены в ядро клетки, произошёл т. н. эндосимбиотический перенос генов. Число белков, функционирующих в хлоропластах, составляет от 2 до 4 тыс. Однако генетический аппарат хлоропластов экспрессирует не более 5–10 % белков для своих нужд, в основном белков электронно-транспортной цепи и некоторые субъединицы АТФ-синтазного комплекса. Остальные 90–95 % белков хлоропластов синтезируются цитоплазматическими рибосомами под контролем ядерных генов (т. н. антероградный контроль). К ним относятся большинство белков пластидной транскрипции, процессинга хлоропластной РНК, пластидных рибосом и регуляторных факторов транскрипции и трансляции.
Хлоропласты содержат рибосомы бактериального типа (с коэффициентом седиментации около 70 ед. Сведберга). Синтез белка в хлоропластах блокируется хлорамфениколом – ингибитором бактериального синтеза, который не действует на синтез белка на 80S-рибосомах эукариот.
Хлоропласты не только воспринимают поступающие к ним сигналы, но и могут генерировать и направлять ядру свой ретроградный сигнал (в виде различных метаболитов, таких как фосфоаденозин-5-фосфат, β-циклоцитраль, метилэритрол-циклодифофат, АФК, Са2+, NO и др.). Этот сигнал информирует ядро о функциональном состоянии хлоропласта, что важно как для нормального роста и развития растений, так и для регуляции их ответных реакций на стрессы, вызванные абиотическими факторами и патогенами. В ответ на такой метаболитный информационный поток происходит изменение экспрессии ядерных генов, кодирующих белки, необходимые хлоропласту.
Хлоропласты обладают способностью делиться независимо от деления клетки, простым бинарным делением. Универсальным компонентом аппарата деления хлоропласта (и прокариот) является белок FtsZ, который формирует кольцевую структуру (т. н. сократительное кольцо) в месте деления, состоящую из актиновых нитей, и таким образом инициирует сжатие пластиды в центре. Делению хлоропласта предшествует удвоение (репликация) молекулы ДНК. Во время деления клетки хлоропласты обязательно распределяются по дочерним клеткам, т. к. они не могут быть ими воспроизведены.
Биогенез
Предшественниками хлоропластов (и других пластид) являются пропластиды – недифференцированные (почти лишённые внутренних мембран) органеллы клеток меристематической ткани размером не более 1 мкм. Обычно клетка содержит от 10 до 20 пропластид округлой формы. Пропластиды окружены двойной мембраной, содержат везикулы с запасными белками, а также рибосомы и ДНК, поэтому способны реплицироваться путём простого деления (именно так увеличивается их число в клетке). Внутренняя мембрана пропластид имеет несколько инвагинаций и ламелл. Созревание хлоропластов из пропластид происходит на свету, в процессе дифференцировки клетки. На ранних стадиях развития хлоропластов внутренняя мембрана оболочки пропластид участвует в формировании тилакоидных мембран, тогда как в зрелых хлоропластах преобладает транспортная система на основе везикул. Считается, что в зрелых хлоропластах и у цианобактерий тилакоиды не связаны с внутренней оболочкой, поскольку на электронно-микроскопических снимках такой связи не наблюдается. Процесс созревания хлоропластов начинается с образования длинных пластинок внутри пропластиды. Позже эти пластинки трансформируются в дискообразные структуры, которые собираются в стопки гран. В итоге возникает сложная и переплетённая мембранная сеть тилакоидов.
Биогенез хлоропластов регулируется светом (фоторегуляция), фитогормонами (гормональная регуляция) и на уровне генов (генетическая регуляция). Ведущая роль в регуляции биогенеза хлоропластов принадлежит ядру клетки, однако пластиды корректируют экспрессию ядерных генов в зависимости от своего функционального состояния. Одним из белков, играющих критическую роль в биогенезе тилакоидов, является белок Vipp1/IM30. Установлено, что именно он контролирует формирование тилакоидов в хлоропластах высших растений и цианобактерий. Нормальный биогенез внутренней мембранной системы хлоропластов происходит только при наличии белка Vipp1/IM30.
У этиолированных (выращенных в темноте) растений пропластиды превращаются в другой предшественник хлоропластов – этиопласты. Эти органеллы имеют сферическую форму и содержат паракристаллическую структуру диаметром около 1–2 мкм, называемую проламеллярным телом, которое состоит из липидов хлоропластов, протохлорофиллида (предшественника хлорофилла) и светозависимого фермента протохлорофиллид-оксидоредуктазы. Проламеллярное тело фактически является хранилищем липидов, которые необходимы для синтеза фотосинтетического аппарата. Липиды проламеллярного тела формируют квазикристаллическую структуру. При освещении проламеллярное тело быстро распадается на сферические везикулы, при этом индуцируется синтез белков мембран и хлорофиллида из протохлорофиллида. Далее везикулы сливаются в диски и формируют тилакоиды. Процесс превращения проламеллярного тела в тилакоидные мембраны занимает несколько часов. Пластоглобулы, содержащиеся в этиопластах, при освещении уменьшаются в размерах, что свидетельствует об их участии в формировании тилакоидов во время биогенеза хлоропластов. При повторном затемнении хлоропластов образуется новое проламеллярное тело. При биогенезе тилакоидов проламеллярные тельца в развивающихся этиопластах играют структурную роль, сходную с ролью пиреноидов в хлоропластах водорослей.
Как правило, клетка содержит пластиды только одного типа. При старении листьев или созревании плодов хлорофилл и тилакоидные мембраны разрушаются, а содержание ферментов биосинтеза каротиноидов увеличивается, что приводит к утрачиванию зелёной окраски и превращению хлоропластов в другой тип пластид – хромопласты.
Хлоропласты, достигшие необратимой стадии старения, называются геронтопластами. От хлоропластов их отличает наличие большого количества пластоглобул, деградация системы тилакоидных мембран и отсутствие крахмальных зёрен.
Происхождение
Наиболее признанной является эндосимбиотическая гипотеза происхождения хлоропластов от прокариотических организмов (теория симбиогенеза), предложенная немецким экологом А. Шимпером в 1883 г. Согласно этой теории, хлоропласты возникли в результате симбиоза фототрофных прокариот – цианобактерий с более крупными первичными эукариотическими клетками (гетеротрофными одноклеточными водорослями или простейшими) примерно 1,5 млрд лет назад. В ходе эволюции цианобактерия (ставшая эндосимбионтом) потеряла свою самостоятельность и между этими двумя клетками установились симбиотические связи, которые привели к образованию из фототрофных прокариотов полуавтономных органелл – хлоропластов. В настоящее время хлоропласты утратили 95 % генов в сравнении со свободноживущими цианобактериями и потеряли способность к самостоятельному внеклеточному существованию.
Считается, что в ходе эволюции симбиогенез цианобактерий с первичными эукариотическими клетками происходил неоднократно, о чём свидетельствует наличие у некоторых фототрофных организмов не двух, а трёх (эвглена, динофлагелляты) и даже четырёх (диатомовые, бурые и другие виды водорослей) мембран, окружающих пластиды.