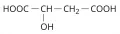Яблочная кислота
Я́блочная кислота́ (2-гидроксибутандиовая кислота, α-гидроксиянтарная кислота), НООС─СН(ОН)─СН2─СООН, двухосновная насыщенная алифатическая гидроксикарбоновая кислота. Существует в виде двух энантиомеров – D-яблочной и L-яблочной кислот. Впервые была выделена К. В. Шееле в 1785 г. из незрелых яблок. Молярная масса 134,09 г/моль. Температура плавления 100 °C (для L-изомера), 98–99 °C (для D-изомера), 128,5 °C (для DL-яблочной кислоты).
Физико-химические свойства
Яблочная кислота – бесцветное кристаллическое вещество, легко растворимое в воде [для DL-яблочная кислоты 144 г/100 мл (26 °C), 411 г/100 мл (79 °C)], этаноле [для DL-яблочной кислоты 35,9 г/100 мл (20 °C), для L-яблочной кислоты 68,3 г/100 мл (20 °C)], растворимое в диэтиловом эфире [для DL-яблочной кислоты 0,6 г/100 мл (20 °C), для L-яблочной кислоты 1,9 г/мл (20 °C)], метаноле и ацетоне (D-яблочная кислота), нерастворимое в бензоле. Константы диссоциации кислоты (pKa) составляют 3,46 и 5,10.
Яблочная кислота обладает свойствами карбоновых кислот и спиртов. Возможно образование сложных эфиров двух типов. Карбоксильная группа (-СООН) участвует в образовании солей, может быть превращена в нитрильную или амидную. Яблочная кислота является одновременно α- и β-гидроксикислотой. Как α-гидроксикислота с галогенидами фосфора даёт α-галогеноацилгалогениды, при окислении – α-кетокислоты, с ионами металлов может образовывать циклические комплексные ионы (хелаты). Как β-гидроксикислота дегидратируются до соответствующих ненасыщенных карбоновых кислот. При нагревании до 100 °С яблочная кислота превращается в ангидрид, при более длительном нагревании до 140–150 °С дегидратируется с образованием фумаровой кислоты, при быстром нагревании до 180 °С даёт также малеиновый ангидрид. Восстановлением яблочной кислоты можно получить янтарную. Окисление яблочной кислоты в зависимости от условий даёт щавелевоуксусную, оксалилуксусную или кумалиновую кислоту.
Способы получения
Эквимолярную смесь (рацемическую смесь) изомеров яблочной кислоты получают восстановлением виноградной кислоты, гидролизом бромянтарной кислоты. L-яблочную кислоту выделяют из природного сырья.
Участие в обмене веществ
В живых организмах L-яблочная кислота существует как анион – L-малат. L-малат образуется в ходе цикла трикарбоновых кислот из фумарата под действием фумаратгидратазы (КФ 4.2.1.2). Следующий шаг – синтез щавелевоуксусной кислоты из яблочной под действием специфичного фермента малатдегидрогеназы (КФ 1.1.1.37) завершает цикл трикарбоновых кислот. При прохождении глиоксилатного цикла малат синтезируется как продукт конденсации глиоксилата и ацетил-производного кофермента А под действием малатсинтазы (КФ 2.3.3.9). Малат обеспечивает транспорт из митохондрий в цитоплазму оксалоацетата, необходимого для прохождения процесса глюконеогенеза. Является промежуточным метаболитом при прохождении С4-фотосинтеза.
В природе в свободном состоянии яблочная кислота присутствует в незрелых яблоках, плодах крыжовника, рябины и других, в виде солей – в листьях махорки, хлопчатника и др.
Применение
Яблочная кислота используется как пищевая добавка Е296 (регулятор кислотности).
В медицине применяется в составе средств для парентерального питания, дегидратации и дезинтоксикации, плазмозамещающих средств.