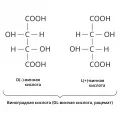
Рацемат
Рацема́т, гомогенная система (твёрдая, жидкая или газообразная), содержащая равные количества двух энантиомеров; не обладает оптической активностью. Термин «рацемат» происходит от названия виноградной кислоты – acidum racemicum (от лат. racemus – виноградная гроздь), на примере которой впервые были тщательно изучены такие вещества. Рацематы в номенклатуре ИЮПАК обозначаются либо с помощью префиксов (±)- или rac-, либо символами RS или (синоним) SR.
Рацематы существуют в виде:
молекулярных соединений (истинные рацематы; их образование обусловлено водородными связями, индукционным или дисперсионным взаимодействием);
конгломератов, представляющих собой простую смесь кристаллов право- и левовращающего антиподов (рацемические смеси кристаллических энантиомеров);
смешанных кристаллов, образованных обоими энантиомерами (рацемические твёрдые растворы).
Физические константы (температура плавления, плотность, растворимость, теплопроводность и др.) истинных рацематов отличны от констант индивидуальных энантиомеров, а их ИК-спектры и рентгенограммы отличаются от тех, которые дают простые смеси этих же веществ. Характер связи между энантиомерами в рацемате может быть определён с помощью диаграммы зависимости температуры плавления от состава: для истинных рацематов она имеет резкий максимум, соответствующий соотношению энантиомеров 1:1, причём температура плавления рацемата может быть как выше (линия Б), так и ниже (А) температур плавления энантиомеров; для конгломерата – резкий минимум в точке эквивалентности; для смешанных кристаллов диаграмма может быть выпуклой (В), вогнутой (Д) или прямой линией (Г).
 Диаграммы плавления рацематов.Неидентичные, но близкие по природе вещества с противоположной абсолютной конфигурацией, например (+)-хлорянтарная и (–)-бромянтарная кислоты, образуют квазирацематы. Диаграмма плавления квазирацемата подобна истинному рацемату.
Диаграммы плавления рацематов.Неидентичные, но близкие по природе вещества с противоположной абсолютной конфигурацией, например (+)-хлорянтарная и (–)-бромянтарная кислоты, образуют квазирацематы. Диаграмма плавления квазирацемата подобна истинному рацемату.
Рацемизация
Рацематы получают при химическом синтезе из оптически неактивных соединений в отсутствие асимметризующего агента или из оптически активных соединений в результате обратимого взаимного превращения энантиомеров – т. н. рацемизации. При рацемизации происходит обмен местами каких-либо двух атомов или радикалов, связанных с элементом хиральности.
Рацемизация, как правило, не самопроизвольный процесс; она вызывается, например, действием кислот, щелочей, повышением температуры. Скорость и механизм рацемизации зависят от строения оптически активных соединений и от условий проведения (температуры, растворителя, катализатора и т. д.). Кинетически рацемизация обычно описывается уравнением для необратимой реакции 1-го порядка: где – константа скорости рацемизации, и – величины первоначального оптического вращения и оптического вращения ко времени .
В зависимости от природы элементов хиральности в молекуле энантиомера, рацемизация может быть химической или физической.
Химическая рацемизация
Химическая рацемизация наиболее характерна для соединений, в молекулах которых хиральным центром является асимметрический атом углерода. Отрыв от него одного из заместителей приводит к образованию плоского карбкатиона и 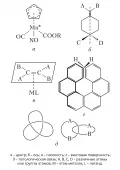 Молекулы с различными элементами хиральности.потере хиральности. Последующее присоединение этого же заместителя происходит равновероятно с обеих сторон плоскости карбкатиона, что приводит к образованию рацемата. По другому механизму рацемизация протекает с промежуточным образованием карбаниона, например в результате отрыва протона от асимметрического атома C. При термической рацемизации в результате гомолитического разрыва связи асимметрического атома с одним из заместителей образуются радикалы, которые при рекомбинации дают рацемат. Лёгкость протекания рацемизации зависит от типа функциональных групп, связанных с асимметрическим атомом C. Легко процесс идёт для соединений, содержащих в качестве заместителей при асимметрическом центре атом водорода и сильный акцептор электронов (например, молочная кислота, дикетоны и т. д.). Соединения, не склонные к образованию промежуточных ионов или таутомерным превращениям, например алканы, устойчивы к рацемизации. Некоторые соединения хотя и образуют промежуточные ионы, но не подвергаются рацемизации, вследствие стерических особенностей структуры их молекул (например, у производных камфоры асимметрический атом С находится в вершине циклической системы и присоединение протона к промежуточному карбаниону возможно только со стороны, противоположной циклической системе).
Молекулы с различными элементами хиральности.потере хиральности. Последующее присоединение этого же заместителя происходит равновероятно с обеих сторон плоскости карбкатиона, что приводит к образованию рацемата. По другому механизму рацемизация протекает с промежуточным образованием карбаниона, например в результате отрыва протона от асимметрического атома C. При термической рацемизации в результате гомолитического разрыва связи асимметрического атома с одним из заместителей образуются радикалы, которые при рекомбинации дают рацемат. Лёгкость протекания рацемизации зависит от типа функциональных групп, связанных с асимметрическим атомом C. Легко процесс идёт для соединений, содержащих в качестве заместителей при асимметрическом центре атом водорода и сильный акцептор электронов (например, молочная кислота, дикетоны и т. д.). Соединения, не склонные к образованию промежуточных ионов или таутомерным превращениям, например алканы, устойчивы к рацемизации. Некоторые соединения хотя и образуют промежуточные ионы, но не подвергаются рацемизации, вследствие стерических особенностей структуры их молекул (например, у производных камфоры асимметрический атом С находится в вершине циклической системы и присоединение протона к промежуточному карбаниону возможно только со стороны, противоположной циклической системе).
Физическая рацемизация
Физическая рацемизация наиболее легко протекает для соединений, молекулы которых имеют неподелённую пару электронов, – при наличии различных заместителей у гетероатома для них возможна оптическая изомерия (амины, фосфины, арсины и другие родственные им соединения). Рацемизация энантиомерных форм этих соединений обусловлена пирамидальной инверсией.
Расщепление рацемата
Обратный рацемизации процесс – выделение энантиомеров из их рацемической смеси – расщепление рацемата. Впервые расщепление рацемата было осуществлено Л. Пастером в 1848 г.  Луи Пастер. Фото: Надар.Для расщепления рацемата используют: механическое разделение кристаллов при визуальном контроле (возможно в тех случаях, когда рацемат представляет собой конгломерат кристаллов лево- и правовращающей форм); биохимический метод, основанный на стереоспецифичности ферментативных реакций; химический метод (наиболее универсальный), заключающийся в том, что на рацемат действуют оптически активным реагентом, в результате чего образуется новая пара веществ – диастереомеров (стереоизомеры, отличающиеся друг от друга частью имеющихся в них элементов хиральности), которые могут быть разделены вследствие различия в физических свойствах (затем хиральный реагент отщепляют); хроматографический метод с применением хиральных неподвижных фаз; ряд других методов.
Луи Пастер. Фото: Надар.Для расщепления рацемата используют: механическое разделение кристаллов при визуальном контроле (возможно в тех случаях, когда рацемат представляет собой конгломерат кристаллов лево- и правовращающей форм); биохимический метод, основанный на стереоспецифичности ферментативных реакций; химический метод (наиболее универсальный), заключающийся в том, что на рацемат действуют оптически активным реагентом, в результате чего образуется новая пара веществ – диастереомеров (стереоизомеры, отличающиеся друг от друга частью имеющихся в них элементов хиральности), которые могут быть разделены вследствие различия в физических свойствах (затем хиральный реагент отщепляют); хроматографический метод с применением хиральных неподвижных фаз; ряд других методов.