Хлороформ
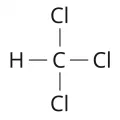
Хлорофо́рм (трихлорметан, метилтрихлорид, хладон 20, фреон 20), органическое вещество; бесцветная прозрачная жидкость с резким сладковатым запахом. Хлорпроизводное метана (алкилгалогенид) общей формулы CHCl3. Один из продуктов комплексной переработки минерального (поваренная соль) и органического сырья.
Историческая справка
Хлороформ впервые получен в 1831 г. независимо друг от друга американским врачом С. Гатри путём перегонки хлорной извести со спиртом, французским учёным Э. Суберейном путём взаимодействия гипохлорита натрия со спиртом или ацетоном, Ю. Либихом путём воздействия щёлочи на хлораль. Точную формулу хлороформа в 1834 г. установил Ж.-Б. Дюма. Он же дал веществу название «хлороформ» (от лат. Acidum formicum – муравьиная кислота, из-за образования её из хлороформа путём гидролиза) (Dumas J.-B. Untersuchung über die Wirkung des Chlors auf den Alkohol // Annalen der Physik und Chemie. 1834. Bd. 31, № 42. P. 654). В 1839 г. Дюма получил хлороформ нагреванием щёлочи с трихлоруксусной кислотой. В 1840 г. А. В. Реньо получил хлороформ хлорированием метилхлорида.
В промышленных условиях производство хлороформа было впервые создано в США в 1860 г. В 1903 г. компаниями Midland Chemical Co. и Dow Chemical Co. создано промышленное производство хлороформа путём восстановления тетрахлорметана. Производство хлороформа – одно из первых крупнотоннажных производств органического синтеза.
Физико-химические свойства
Бесцветная жидкость со сладковатым запахом; молярная масса 119,38 г/моль; tпл –63,5 °C, tкип 61,1 °C. Плотность хлороформа при разных температурах представлена в таблице 1.
Таблица 1. Плотность хлороформа
Т, °С | –20 | 20 | 60 | 100 |
ρ, кг/м3 | 1564 | 1483 | 1394 | 1315 |
Относительная плотность паров по воздуху 4,12; температурный коэффициент объёмного расширения 0,001273 °С −1 (при 20 °С); теплота сгорания 373,46 кДж/кг; теплота плавления 77,04 кДж/кг; теплота испарения 246,6 кДж/кг (при 61,2 °С) ; стандартная энтальпия образования (газ) −89,58 кДж/моль; стандартная энтальпия образования (жидкость) −120,8 кДж/моль; энтропия вещества в стандартном состоянии 295,84 Дж/(моль · К); дипольный момент 3,67 . 10−30 Кл · м (в CCl4); дипольный момент 3,9 . 10−30 Кл · м (в С6Н6). Параметры критического состояния: критическое давление 5,38 МПа; критическая температура 263,4 °С; критическая плотность 500 кг/м3.
Растворимость в воде 0,32 % (при 30 °С), растворимость воды в хлороформе 0,093 % (при 25 °С).
Растворимость хлороводорода в хлороформе 0,55 % (при 20 °С), растворимость хлора в хлороформе 7,65 % (при 25 °С).
Хлороформ образует с рядом соединений азеотропные смеси (таблица 2).
Таблица 2. Азеотропные смеси, образуемые хлороформом
Химические свойства
1. Галогенирование.
Хлороформ хлорируется в жидкой фазе в присутствии инициаторов или фотохимически и в газовой фазе в присутствии катализаторов до тетрахлорметана:
При температурах на уровне 250 °С при действии брома образуются бромхлорметаны – CCl3Br, CCl2Br2, CClBr3.
Свободный фтор не действует на хлороформ. При взаимодействии с фтористым водородом в присутствии фторидов металлов (например, сурьмы) получается трифторметан:
2. Гидролиз.
От действия воды при нагревании хлороформ разлагается с образованием муравьиной кислоты, оксида углерода и хлороводорода:
При действии разбавленного раствора гидроксида натрия (или калия) образуется муравьинокислый натрий (или калий):
Действие концентрированной щёлочи ведёт к образованию оксида углерода:
3. Восстановление.
На катализаторах, содержащих платину или палладий, хлороформ восстанавливается при избытке водорода до метана:
4. Окисление.
На свету хлороформ медленно окисляется кислородом воздуха:
5. Аминирование.
При действии аммиака и гидроксида калия образуется цианистый калий:
6. Алкилирование.
В присутствии хлористого алюминия хлороформ вступает в реакцию алкилирования с ароматическими соединениями:
7. Действие ацетона.
В присутствии гидроксидов щелочных металлов хлороформ конденсируется с ацетоном, давая трихлорбутанол:
8. Реакция Реймера – Тимана.
Хлороформ реагирует с фенолами в щелочных растворах, образуя ароматические о-оксиальдегиды:
9. Пиролиз.
Хлороформ пиролизуется в газовой фазе при температурах выше 450 °С, при этом получаются перхлорэтилен и хлороводород:
10. Действие диоксида азота.
Хлороформ при действии диоксида азота окисляется с образованием фосгена, а также оксида азота и хлороводорода:
Пожароопасные и токсические свойства
Хлороформ не горюч, пожаро- и взрывобезопасен. Обладает наркотическими свойствами, оказывает токсическое действие на организм человека. Относится ко второму классу опасности. Предельно допустимая концентрация паров в воздухе рабочей зоны производственных помещений 5 мг/дм3.
Методы синтеза
1. Хлорирование метана:
2. Взаимодействие ацетона (этилового спирта, метилацетата) с хлорной известью:
3. Восстановление тетрахлорметана парафиновыми углеводородами С1–С3 или их хлорпроизводными в присутствии цинка:
Промышленное производство
В промышленном масштабе хлороформ получают как хлорированием метана (или метилхлорида), так и из хлораля. Последний способ широко эксплуатировался в 1950–1960-х гг.; в 21 в. признан устаревшим по технико-экономическим показателям.
Процесс получения хлороформа из метана, осуществляемый в псевдоожиженном слое контакта, включает следующие стадии:
очистка метана;
хлорирование;
отпаривание кислых газов;
ректификация хлорметанов с выделением товарных продуктов;
абсорбция хлороводорода с получением соляной кислоты.
Краткое описание схемы
Метан предварительно очищают от высших гомологов гидрированием на палладиевом катализаторе при 220 °С, после чего он в смеси с хлором в мольном соотношении 1:1,25 поступает в реактор хлорирования с псевдоожиженным слоем контакта. Хлорирование ведётся при 350 °С. Реакционные газы поступают на сухую нейтрализацию, где происходит отпаривание кислых газов. После этого газы поступают в систему абсорбции, где получается очищенная товарная соляная кислота. Смесь органических продуктов процесса поступает далее на ректификацию, где выделяются товарные продукты – хлороформ и метиленхлорид, а также тетрахлорметан, возвращаемый на переработку. Соотношение хлороформа и метиленхлорида может варьироваться в зависимости от потребности.
Мировое производство до 1,5 млн т в год (2023).
Применение
Во второй половине 19 – начале 20 вв. хлороформ использовался как анестетик при проведении хирургических операций. Впервые это направление его применения было предложено в 1847 г. шотландским врачом Дж. Симпсоном. В начале 1850-х гг. оно было развито российским врачом Н. И. Пироговым. В 20 в. данное направление использования хлороформа потеряло своё значение.
Основные направления использования хлороформа во второй половине 20 – начале 21 вв. – производство (поли)тетрафторэтилена (фторопласта) и хлордифторметана (хладона 22). На получение этих продуктов расходуется до 90 % производимого хлороформа. В небольших количествах хлороформ используют как растворитель в фармакологической промышленности, а также для производства красителей и пестицидов.