Интеркалаты
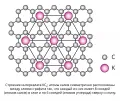
Интеркала́ты, супрамолекулярные слоистые соединения включения (клатраты), образующиеся путём внедрения атомов, ионов или молекул одного вещества («гостя») в межслоевое пространство другого вещества («хозяина»). В роли вещества типа «хозяина» выступают слоистые материалы, такие как графит, гексагональный нитрид бора (α-BN), чёрный фосфор, силицен, дихалькогениды переходных металлов (например, MoS2, MoSe2, WS2 и др.), слоистые двойные гидроксиды (например, (BiO)4(OH)2CO3), металл-органические каркасные структуры (например, Cd(4,4’-бипиридин)2(NO3)2), ковалентные органические каркасные структуры, максены (MXenes) и др. В качестве вещества типа «гостя» (интеркалята) могут выступать атомы металлов (Li, Cu, Fe и т. д.), анионы кислот (SO42–, NO3– и т. д.), различные молекулы (I2, Br2, FeCl3 и т. д.) и др.
Интеркалаты образуются посредством интеркаляции (введения) молекул «гостя» в межслоевое пространство слоистого материала. При интеркаляции наблюдается увеличение межслоевого расстояния, зависящее от размеров молекул «гостя». 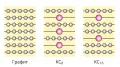 Строение молекул интеркалатов.
Архив БРЭ.При увеличении межслоевого расстояния до критического уровня происходит эксфолиация материала.
Строение молекул интеркалатов.
Архив БРЭ.При увеличении межслоевого расстояния до критического уровня происходит эксфолиация материала.
Способы получения интеркалатов разделяют на 4 группы в зависимости от среды и движущей силы синтеза: жидкофазную, газофазную, электрохимическую и ионообменную интеркаляцию.
Жидкофазная интеркаляция заключается в погружении слоистого материала в раствор, содержащий интеркалят при определённой температуре. Метод прост в исполнении и легко масштабируется, но при проведении интеркаляции сложно контролировать стехиометрию, структуру и свойства интеркалата и для успешной интеркаляции необходим подбор прекурсоров, способных реагировать при данных условиях.
При газофазной интеркаляции молекулы интеркалята переводятся в газообразное состояние с последующей диффузией к слоистому материалу. Данный метод является эффективным и масштабируемым, однако для успешной интеркаляции необходимо использование высоких температур и интеркалята, стабильного при данной температуре.
При электрохимической интеркаляции в качестве интеркалятов используются ионы, которые проникают в межслоевое пространство при протекании электрохимических реакций. Слоистый материал выступает в качестве катода при интеркаляции положительно заряженными ионами и анодом при интеркаляции отрицательно заряженными ионами. В отличие от жидкофазной интеркаляции при электрохимической за счёт регулирования прикладываемого напряжения легко контролировать стехиометрию и структуру получаемого интеркалата. Данный метод неприменим для интеркаляции непроводящих электричество слоистых материалов.
Ионообменная интеркаляция заключается в замещении одного интеркалята в слоистом материале другим. С помощью ионообменной интеркаляции возможно получать интеркалаты, которые сложно получить описанными выше методами.
При образовании интеркалатов происходят энергетически выгодное образование соединений типа «гость-хозяин» и энергетически невыгодные расширение решётки слоистого материала и электростатическое отталкивание молекул «гостя» друг от друга. Поэтому для снижения энергии системы интеркаляты не заполняют межслоевые пространства в случайном порядке, заполнение одного межслоевого пространства происходит прежде, чем начинается заполнение следующего. Причём заполнение соседних межслоевых пространств энергетически невыгодно – следующее заполнение происходит через несколько слоёв «хозяина» от уже заполненного.
Интеркалаты характеризуются стадиями заполнения, которые показывают, через какое количество слоёв «хозяина» встречается интеркалят; т. е. если буквой А обозначить слой «хозяина», а буквой Б слой «гостя», то интеркалату 1 стадии будет соответствовать структура АБАБАБ, интеркалату 2 стадии – ААБААБААБ, 3 стадии – АААБАААБ и др.
За счёт процессов переноса заряда между «гостем» и «хозяином» значительно изменяются электронные свойства слоистого кристалла – происходит сдвиг уровня Ферми, изменяется его зонная структура и увеличивается плотность состояний и др. В результате возможно увеличение электропроводности, плотности носителей заряда, изменение цвета и прозрачности, основного типа носителей заряда, изменение кристаллической решётки слоистого кристалла и его электронной структуры, появление сверхпроводимости и т. д.
Возможность регулирования свойств интеркалатов в широких пределах сделало их перспективными кандидатами для использования в качестве прозрачных электродов, катализаторов и носителей катализаторов, гибких электронных сенсоров, электродов для суперконденсаторов, аккумуляторов водорода и т. д.