Гликолиз
Глико́лиз (от греч. γλυκύς – сладкий и ...лиз), ферментативный процесс анаэробного (протекающего без участия кислорода) расщепления глюкозы, сопровождающийся накоплением энергии, запасаемой в виде аденозинтрифосфата (АТФ).
Место гликолиза в метаболизме живых организмов
Широко распространён в природе, играет важную роль в метаболизме живых организмов. Гликолиз лежит в основе различных видов брожения. У облигатных анаэробных микроорганизмов, а также в некоторых клетках животных и человека (например, зрелые эритроциты млекопитающих) гликолиз – единственный процесс, поставляющий энергию. В аэробных условиях у большинства организмов гликолиз предшествует окислительному распаду органических соединений до углекислого газа (СО2) и воды (Н2О). У высших животных гликолиз интенсивно протекает в скелетных мышцах, печени, сердце, эритроцитах, сперматозоидах, быстро делящихся (в т. ч. опухолевых) клетках. Ферменты гликолиза локализованы в растворимой части цитоплазмы клеток.
Стадии гликолиза
Полная детальная расшифровка отдельных реакций гликолиза была осуществлена главным образом благодаря работам немецких биохимиков Г. Эмбдена, Ф. О. Мейергофа, О. Варбурга, К. Нейберга, а также Я. О. Парнаса и К. Ф. Кори (1930–1937). Иногда гликолиз называют «путём Эмбдена – Мейергофа – Парнаса».
Условно в процессе гликолиза выделяют две стадии.
Подготовительная стадия
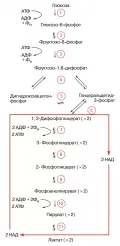 Схема гликолиза.На первой (подготовительной) стадии сначала происходит фосфорилирование глюкозы (реакция 1), катализируемое ферментом гексокиназой (иногда глюкокиназой) и требующее затраты энергии молекулы АТФ (см. схему).
Схема гликолиза.На первой (подготовительной) стадии сначала происходит фосфорилирование глюкозы (реакция 1), катализируемое ферментом гексокиназой (иногда глюкокиназой) и требующее затраты энергии молекулы АТФ (см. схему).
Образовавшийся глюкозо-6-фосфат при участии фермента фосфоглюкоизомеразы превращается (2) во фруктозо-6-фосфат, который в свою очередь фосфорилируется (для этого требуется ещё одна молекула АТФ) с помощью фосфофруктокиназы-1 (3) с образованием фруктозо-1,6-дифосфата.
Последний с помощью фруктозо-1,6-дифосфатальдолазы (4) расщепляется до двух фосфотриоз: глицеральдегид-3-фосфата и дигидроксиацетонфосфата. Последний легко изомеризуется под действием триозофосфатизомеразы в глицеральдегид-3-фосфат (5). В дальнейшем используется только первое соединение.
Таким образом, из одной молекулы глюкозы на первой стадии гликолиза образуются две молекулы глицеральдегид-3-фосфата и при этом используется энергия двух молекул АТФ.
Основная стадия
На второй – основной стадии гликолиза – глицеральдегид-3-фосфат претерпевает серию последовательных превращений, приводящих к образованию пировиноградной кислоты (ионизированная формула – пируват) и выделению энергии, аккумулируемой в виде АТФ.
Сначала при участии фермента глицеральдегид-3-фосфатдегидрогеназы (6), в присутствии кофермента никотинамидадениндинуклеотида (НАД), который участвует в окислении альдегидной группы, переходя при этом в восстановленную форму (НАДН), и неорганического фосфата (Фн) происходит превращение глицеральдегид-3-фосфата в высокоэнергетическое соединение – 1,3-ди-фосфоглицерат.
Затем в реакции т. н. субстратного фосфорилирования, которую осуществляет фермент фосфоглицераткиназа (7), происходит перенос фосфорильной группы с 1,3-дифосфоглицерата на аденозиндифосфат (АДФ) с образованием АТФ. Другой продукт этой реакции – 3-фосфоглицерат при участии фермента фосфоглицератмутазы (8) подвергается изомеризации в 2-фосфоглицерат.
После этого в результате реакции отщепления молекулы воды, которую осуществляет фермент енолаза (9), происходит образование фосфоенолпирувата и в процессе ещё одной реакции субстратного фосфорилирования, которую катализирует фермент пируваткиназа (10), фосфорильная группа фосфоенолпирувата переносится на АДФ с образованием очередной молекулы АТФ.
Следовательно, за вычетом затраченных на подготовительной стадии двух молекул АТФ в конечном итоге при распаде глюкозы образуются две молекулы АТФ.
Особенности гликолиза в разных типах клеток
Дальнейшая судьба образовавшегося пирувата и НАДН определяется особенностями метаболизма конкретных типов клеток и их обеспеченностью кислородом.
В аэробных условиях пируват и восстановленные эквиваленты от НАДН (гидрид-ион) поступают в митохондрии, где происходит превращение пирувата в ацетил-КоА, который поступает в цикл трикарбоновых кислот.
В отсутствии кислорода НАДН используется на восстановление пирувата в лактат (ионизированная форма молочной кислоты). Это необходимо для получения НАД, без которого невозможно протекание глицеральдегид-3-фосфатдегидрогеназной реакции, а значит и всего гликолиза.
В молочнокислых бактериях, а также в белых мышцах (обеднённых митохондриями по сравнению с красными мышцами) лактат является конечным продуктом гликолиза. У дрожжей пируват превращается в этанол (спиртовое брожение).
Другие гексозы (галактоза, манноза, фруктоза), пентозы и глицерин могут включаться в гликолиз на разных его стадиях (например, стадии 2, 3, 5).
Поставщиком остатков глюкозы для нужд гликолиза у животных может также служить гликоген (в этом случае процесс называют гликогенолизом, он наиболее интенсивно протекает в мышцах), а у растений – крахмал, остатки глюкозы которых вовлекаются в гликолиз благодаря действию ферментов, приводящих к образованию сначала глюкозо-1-фосфата, а затем глюкозо-6-фосфата.
Регуляция гликолиза
В присутствии кислорода скорость гликолиза снижается в связи с началом процесса дыхания (эффект Пастера), которое обеспечивает более эффективный механизм образования богатых энергией связей. В опухолевых клетках, безъядерных эритроцитах, эмбриональных и некоторых других тканях эффект Пастера ослаблен или отсутствует вовсе (т. н. аэробный гликолиз).
Все реакции гликолиза, за исключением 1, 3 и 10-й, обратимы. Ферменты, катализирующие эти три реакции, являются объектами сложной регуляции. Скорость гликолиза лимитирует фосфофруктокиназа-1. Этот фермент активируют фруктозо-2,6-дифосфат, АДФ и аденозинмонофосфат (АМФ), а ингибируют АТФ и цитрат (ионизированная форма лимонной кислоты). АТФ подавляет также активность гексокиназы и пируваткиназы. Образование мощного активатора гликолиза – фруктозо-2,6-дифосфата – из фруктозо-6-фосфата осуществляет особый фермент фосфофруктокиназа-2.
Гормоны адреналин и глюкагон через систему внутриклеточной сигнализации, включающую образование циклического 3’,5’-аденозинмонофосфата (цАМФ) и активацию фермента протеинкиназы, вызывают фосфорилирование и инактивацию пируваткиназы в печени, но не в мышцах. Такая тканеспецифичная регуляция необходима для эффективного протекания глюконеогенеза в печени.
Установлено, что некоторым ферментам гликолиза свойствен ряд функций, не связанных с этим процессом. Например, глицеральдегид-3-фосфатдегидрогеназа может переноситься в ядро и участвовать в индукции апоптоза, активируя процессы транскрипции.
