Апоптоз
Апопто́з (от греч. ἀπόπτωσις – опадение), процесс саморазрушения клеток по генетически детерминированной программе в ответ на определённые внешние или внутренние стимулы; один из видов запрограммированной гибели клеток (ЗГК). В отличие от случайной гибели клеток при повреждении, апоптоз – нормальный физиологический процесс, однако в некоторых случаях является звеном патогенеза некоторых состояний.
Апоптоз хорошо известен в биологии как один из механизмов эмбрионального развития (например, отмирание хвоста у головастика, ранние этапы формирования пальцев у эмбриона позвоночных). Концепция апоптоза как общей биологической программы сформулирована английскими учёными Дж. Керром, Э. Уайлли и А. Карри в 1972 г. Они же предложили и сам термин.
Функции апоптоза
Играет центральную роль в иммунных процессах, обеспечивая, в частности, гибель незрелых Т-лимфоцитов, реагирующих на «cвои» антигены, и формирование разнообразия В-лимфоцитов. Выключение программы апоптоза ведёт к развитию рака и аутоиммунных заболеваний. Защитная функция апоптоза проявляется в самоуничтожении клеток, повреждённых стрессами или заражённых вирусами. Этот механизм направлен на предотвращение развития инфекции, образования генетически изменённых клеток и клеток, образующих токсичные для организма вещества. У высших растений гибель клеток, окружающих заражённый участок (т. н. гиперчувствительный ответ), является основным механизмом защиты от инфекции. Избыточный апоптоз клеток вокруг повреждённых участков ткани ведёт к развитию ишемических нарушений в сердце (инфаркт) и в мозге (инсульт), а также к посттравматическим повреждениям позвоночника. Апоптоз нервных клеток определяет развитие нейродегенеративных заболеваний (болезни Альцгеймера, Паркинсона, Хантингтона), а апоптоз лимфоцитов, по-видимому, лежит в основе развития СПИДа.
Фазы апоптоза
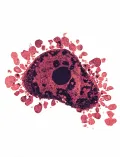
Основными морфологическими признаками апоптоза являются округление и сжатие клетки, приводящие к её отделению от ткани, образование короткоживущих вздутий («блеббов») на её поверхности, сжатие и фрагментация ядра и, наконец, распад на окружённые мембраной фрагменты – апоптозные тельца. Один из ранних биохимических признаков апоптоза – появление на поверхности клетки фосфатидилсерина – фосфолипида, который в норме находится на внутренней поверхности клеточной мембраны. 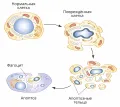 Апоптоз.Это служит сигналом для макрофагов и других фагоцитирующих клеток, которые поглощают апоптозные клетки и тельца, не позволяя их содержимому выйти в окружающую среду и вызвать воспалительную реакцию. Важнейшие отличительные признаки апоптоза – конденсация хроматина (ядерного комплекса ДНК и белков) и последовательная упорядоченная фрагментация ДНК.
Апоптоз.Это служит сигналом для макрофагов и других фагоцитирующих клеток, которые поглощают апоптозные клетки и тельца, не позволяя их содержимому выйти в окружающую среду и вызвать воспалительную реакцию. Важнейшие отличительные признаки апоптоза – конденсация хроматина (ядерного комплекса ДНК и белков) и последовательная упорядоченная фрагментация ДНК.
Основным модельным организмом для изучения апоптоза является нематода Caenorhabditis elegans. В настоящее время гены и белки, контролирующие программу апоптоза, детально изучены. Ключевыми компонентами этой программы являются каспазы – целое семейство протеаз, расщепляющих белки рядом с остатком аспарагина со стороны C-конца. Известно 12 каспаз, обеспечивающих механизм апоптоза у высших эукариот. Исходно каспазы находятся в клетке в неактивном состоянии в форме зимогенов.
Регуляция апоптоза
Сигнал к запуску апоптоза может поступить клетке извне от специфических рецепторов некоторых цитокинов (например, фактора некроза опухолей) или от внутриклеточных систем (например, при репликации ДНК, секреции белков и др.) при нарушении их функционирования. В обоих случаях передача сигнала апоптоза требует дополнительных механизмов усиления, которые обеспечиваются другими белками, принадлежащими к т. н. семейству Bcl-2. Их активация сопровождается выходом в цитоплазму белков из межмембранного пространства митохондрий, в том числе цитохрома с, участвующего в клеточном дыхании. При его связывании в цитоплазме с адапторным белком Apaf-1 образуется гигантский комплекс – апоптосома, в котором происходит активация одной из каспаз. Далее каспазы по очереди расщепляют и активируют друг друга в ходе каскада реакций. Тем самым они усиливают первоначальный сигнал. Расщепление каспазами многочисленных белковых субстратов внутри клетки обеспечивает её разрушение. Одним из конечных путей апоптоза является активация каспазами ядерных эндонуклеаз, которые последовательно расщепляют хромосомную ДНК на фрагменты до 200 пар нуклеотидов, что формирует картину упорядоченной фрагментации ДНК, наблюдаемую при апоптозе.
Важную роль в механизме апоптоза играют ионы Ca2+, церамид (продукт гидролиза сфинголипидов) и активные формы кислорода (АФК). При повышении их концентрации в цитоплазме запускаются и усиливаются сигнальные механизмы апоптоза. Долгоживущие АФК (например, пероксид водорода) участвуют также в межклеточной передаче сигнала апоптоза.
В семейство Bcl-2 входят также белки, блокирующие выход цитохрома c из митохондрий и ингибирующие апоптоз. Другое семейство белков (IAP) включает в себя ингибиторы каспаз, блокирующие апоптоз на завершающих стадиях. Активация антиапоптозных белков (наряду с инактивацией проапоптозных, таких как белок р53) характерна для многих типов опухолей, что обеспечивает бесконтрольное размножение раковых клеток и их повышенную устойчивость к химио- и лучевой терапии.