Глюкоза
Глюко́за (от греч. γλυκύς – сладкий) [виноградный сахар, декстроза, (2R,3S,4R,5R)-2,3,4,5,6-пентагидроксигексаналь, (2R,3S,4R,5R)-6-(гидроксиметил)тетрагидро-2H-пиран-2,3,4,5-тетраол, 6-(гидроксиметил)оксан-2,3,4,5-тетраол], органическое соединение, альдоза, моносахарид группы гексоз, CH2OH(CHOH)4CHO. В природе имеет D-конфигурацию; существует в виде циклических полуацеталей с образованием 6-членных колец: α-D-глюкопираноза и β-D-глюкопираноза. Молярная масса 180,16 г/моль. Плотность 1,562 г/см3. Температура плавления 146 °C (безводная α-D-глюкопираноза), 83 °C (моногидрат α-D-глюкопиранозы), 148–150 °C (безводная β-D-глюкопираноза). В чистом виде глюкоза впервые была выделена из виноградного сока (1747, А. Маргграф).
Глюкоза является самым распространенным в природе моносахаридом, служит универсальным, а для некоторых тканей, например мозга, и единственным источником энергии.
Физико-химические свойства
Глюкоза – бесцветное кристаллическое вещество, обладающее сладким вкусом, хорошо растворимо в воде [для α-D-глюкопиранозы: 32,3 г/100 мл (0 °C), 82 г/100 мл (25 °C), для β-D-глюкопиранозы: 154 г/100 мл (15 °C)], растворимо в 80 %-ном этиловом спирте [2 г/100 мл (α-D-глюкопираноза), 4,9 г/100 мл (β-D-глюкопираноза)], горячем этиловом спирте, горячем пиридине, малорастворимо в метиловом спирте, нерастворимо в ацетоне, диэтиловом эфире.
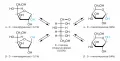
α-D-глюкоза и β-D-глюкоза образуют кристаллы с удельным вращением [α]=+112,2° и +18,7° соответственно. При растворении в воде между двумя формами устанавливается равновесие – происходит медленное изменение оптического вращения (мутаротация) до [α]=+52,7°. В равновесной смеси содержится 64% β-формы, 36% α-формы и следовые количества 5-членных циклических форм (фураноз) и открытой (альдегидной) формы глюкозы.
Глюкоза вступает во все реакции, типичные для моносахаридов. Под действием боргидрида натрия D-глюкоза восстанавливается до D-глюцита (сорбита). Окисление азотной кислотой приводит к образованию D-глюкаровой кислоты. Использование более мягких окислителей (бромная вода) позволяет получение D-глюконовой кислоты. На способности альдоз, в частности глюкозы, восстанавливать катионы металлов основаны качественные реакции на сахара с реактивами Толленса (аммиачный раствор оксида серебра; реакция «серебряного зеркала»), Бенедикта и Фелинга (оба содержат сульфат двухвалентной меди в щелочном растворе; выпадает красный осадок оксида одновалентной меди). Окислительная деградация глюкозы метапериодатом натрия приводит к образованию формальдегида и муравьиной кислоты. В результате реакции с избытком фенилгидразина образуются озазоны. Глюкоза вступает в реакцию этерификации с ангидридами карбоновых кислот. Гликозидный (полуацетальный) гидроксил глюкозы легко замещается на другие нуклеофилы. Глюкоза образует алкоголяты (сахараты) со щелочными и щелочноземельными металлами и их гидроксидами. Под действием последних может происходить как усложнение (путем альдольной конденсации), так и деградация (путем ретроальдольного распада) углеродной цепи.
Способы получения
В промышленных масштабах глюкозу получают путём кислотного или ферментативного гидролиза картофельного или кукурузного крахмала.
Участие в обмене веществ
Глюкоза образуется в результате фотосинтеза (в растениях) и в процессе глюконеогенеза (у животных). В свободном состоянии она накапливается в цветках и плодах растений (особенно много глюкозы содержится в виноградном соке), присутствует в крови человека (0,1%). Основные количества природной глюкозы находятся в связанном виде в форме различных гликозидов, резервных дисахаридов (сахароза растений, лактоза животных, трегалоза насекомых и грибов) и полисахаридов (крахмал растений, гликоген животных, декстраны бактерий) и структурных полисахаридов (целлюлоза и гемицеллюлозы растений, глюканы грибов).
Основное физиологическое назначение катаболизма глюкозы заключается в использовании энергии, освобождающейся в этом процессе, для синтеза АТФ.
Метаболиты гликолиза используются для синтеза новых соединений: рибозо-5-фосфата – структурного компонента нуклеотидов; аминокислот, таких как серин, глицин, цистеин. В печени и жировой ткани ацилированное производное кофермента А, образующееся из пирувата, используется как субстрат при биосинтезе жирных кислот, холестерина.
Важное значение имеют производные глюкозы, содержащие карбоксильную группу: глюкуроновая кислота, образуя растворимые конъюгаты с токсичными веществами, участвует в детоксикации организма; гликозаминогликаны играют важную роль в межклеточных взаимодействиях, формировании и поддержании формы клеток и органов, образовании каркаса при формировании тканей.
Применение
Глюкозу применяют в медицине: для восполнения потери крови в виде изотонического раствора, при явлениях сердечной недостаточности, шоке, отравлениях и др. Глюкоза является исходным соединением при производстве аскорбиновой кислоты; применяется в пищевой промышленности. Превращения глюкозы в условиях брожения лежат в основе биотехнологического получения этилового спирта и ряда других ценных продуктов.