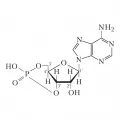
Циклический аденозинмонофосфат
Цикли́ческий аденозинмонофосфа́т (циклический 3´,5´-аденозинмонофосфат, циклический АМФ, цАМФ, 3´5´-цAMФ, 3´5´-cAMP), производное АТФ, вторичный посредник, необходимый для внутриклеточной передачи сигналов ряда гормонов, неспособных проходить через мембрану клетки.
Физические и химические характеристики
Циклический АМФ представляет собой бесцветные кристаллы, хорошо растворимые в воде, т. е. обладает гидрофильными свойствами. Ячейка кристалла состоит из двух молекул: адениновое основание в одной из них относительно рибозного кольца находится в син-, а другой – в антиконформации. Na−, K− и аммониевые соли цАМФ также хорошо растворимы в воде; соли двухвалентных металлов и Ag+ в воде практически не растворяются.
История открытия
Циклический АМФ был открыт американским биохимиком Э. У. Сазерлендом в 1957 г. в ходе исследования механизма гликогенолиза, запускаемого адреналином. Сазерленд обнаружил, что активация фермента фосфорилазы, катализирующего образование глюкозы из гликогена, происходит при помощи промежуточного соединения – вторичного посредника, которым оказался цАМФ. Таким образом, цАМФ стал первым открытым вторичным мессенджером. Позднее оказалось, что не только адреналин, но и многие другие первичные мессенджеры (гормоны, нейротрансмиттеры и др.) работают подобным образом: не проникают внутрь клетки, а взаимодействуют с GPCR-рецепторами (G-protein-coupled receptors – рецепторы, сопряжённые с G-белком; рецепторы серпантинного типа) класса Е на её поверхности, что приводит к активации мембраносвязанной аденилатциклазы и, как результат, к образованию цАМФ, активирующего или, наоборот, ингибирующего различные процессы (аденилатциклазный или цАМФ-зависимый путь). В 1971 г. Сазерленд получил Нобелевскую премию по физиологии и медицине «за открытия, касающиеся механизмов действия гормонов» (The Nobel Prize in Physiology or Medicine 1971 // The Nobel Prize). цАМФ был обнаружен не только у животных и растений, но и у бактерий, у которых он играет роль «примитивного гормона».
Регуляция и функция в организме
Выработка цАМФ в клетке регулируется аденилатциклазой, фосфодиэстеразой (ФДЭ). цАМФ активирует цАМФ-зависимую протеинкиназу А. Ферменты из этого семейства фосфорилируют белки-субстраты по остаткам аминокислот серина и треонина, что позволяет регулировать различные клеточные процессы. После передачи сигнала цАМФ гидролизуется до 5'-АМФ при помощи цАМФ-фосфодиэстеразы. цАМФ также активирует рецепторы, представляющие собой мембранные белки из подсемейства Epac (exchange protein directly activated by cAMP – обменный белок, напрямую активируемый цАМФ).
Таким образом, цАМФ влияет на клеточную адгезию, межклеточные соединения, дифференцировку и пролиферацию клеток, транспорт веществ, экспрессию генов и апоптоз, регулирует синтез и гидролиз гликогена в печени, кроветворение, количество тромбоцитов, мышечные сокращения, секрецию гормонов и др.
Взаимодействие цАМФ с ферментами из семейств протеинкиназы А и Epac может оказывать как антагонистический, так и синергический эффект.
На уровень цАМФ могут влиять некоторые бактерии, вырабатывающие вещества, инактивирующие G-белок (например, такое действие оказывает коклюшный токсин, вырабатываемый Bordetella pertussis); изменение внутриклеточной концентрации цАМФ влияет на восприимчивость к инфекциям. Концентрация цАМФ и регулирующих его гормонов может меняться на фоне интенсивных физических упражнений, а также нейродегенеративных, онкологических и других заболеваний.