Протеинкиназы
Протеинкина́зы, обширная группа ферментов, относящихся к классу трансфераз, а точнее – фосфотрансфераз (киназ). Осуществляют перенос терминального фосфатного остатка от аденозинтрифосфата (АТФ) и гуанозинтрифосфата (ГТФ) на различные аминокислотные остатки (в том числе на остатки гистидина, аспарагиновой кислоты, серина, тирозина и треонина) в молекулах белков, таким образом осуществляя их фосфорилирование. Это приводит к локальному изменению заряда белка-мишени и часто сопровождается значительным изменением его структуры и свойств.
В тканях человека обнаружено свыше 500 генов, кодирующих различные протеинкиназы. В их молекулах выделяется довольно консервативный каталитический домен, структура которого практически одинакова у всех протеинкиназ, и один или несколько регуляторных доменов, для которых характерно структурное разнообразие. Активность протеинкиназ может регулироваться низкомолекулярными соединениями (ионами кальция Ca2+, нуклеотидами, липидами), специальными белками и/или пептидами (кальмодулин, белки-активаторы и/или белки-ингибиторы, белковые и пептидные гормоны), а также путём фосфорилирования отдельных участков фермента под действием других протеинкиназ.
Протеинкиназы играют важную роль в передаче гормональных сигналов и регуляции многочисленных реакций, протекающих в клетке. Например, связывание некоторых гормонов (в том числе инсулина, факторов роста) с рецептором на поверхности клеточной мембраны приводит к активации тирозиновых протеинкиназ (тирозинкиназ), которые являются либо составной частью рецептора, либо связываются с ним после его контакта с гормоном. Тирозинкиназы фосфорилируют остатки тирозина, расположенные или на самом рецепторе, или на специальных адапторных белках, локализованных поблизости от него. Это приводит к сборке вблизи мембраны активированного рецептора большого белкового комплекса, в состав которого могут входить различные протеинкиназы и т. н. G-белки, способные связывать и гидролизовать ГТФ и регулировать активность различных ферментов, в том числе обеспечивающих синтез циклических нуклеотидов, участвующих в регуляции уровня кальция внутри клетки или обеспечивающих расщепление фосфолипидов и накопление определённых промежуточных соединений.
Появление таких вторичных посредников (вторичных мессенджеров) приводит к активации отдельных классов протеинкиназ. При этом формируется своеобразная иерархическая лестница: наверху располагаются протеинкиназы, активность которых напрямую регулируется гормонами или вторичными посредниками, а в основании – протеинкиназы, активность которых регулируется цепочкой из нескольких протеинкиназ, расположенных выше. Вследствие этого становится возможным каскадный механизм усиления гормонального сигнала, который может включать три и более регулирующие друг друга протеинкиназы. Всё это приводит к многократному усилению гормонального сигнала и его передаче в глубь клетки. Субстратами протеинкиназ могут быть различные ферменты, факторы транскрипции, сократительные и регуляторные белки, транспортные АТФазы, белки цитоскелета и многие другие внутриклеточные белки.
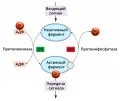
Изменения структуры белков, вызванные фосфорилированием, могут быть обращены путём дефосфорилирования, которое осуществляется протеинфосфатазами, ферментами, относящимися к классу гидролаз. Протеинкиназы и протеинфосфатазы являются ферментами-антагонистами, которые могут регулировать активность друг друга. Катализируемое протеинкиназами фосфорилирование определённых белков-ингибиторов приводит к ингибированию протеинфосфатаз, а катализируемое протеинфосфатазами дефосфорилирование зачастую приводит к ингибированию протеинкиназ. Активность протеинфосфатаз регулируется различными вторичными посредниками (например, ионами Ca2+) и специальными белками-регуляторами, либо непосредственно оказывающими воздействие на активность фосфатаз, либо влияющими на их внутриклеточную локализацию.
Координированная регуляция активности протеинкиназ и протеинфосфатаз является необходимым условием нормального функционирования клетки, а нарушение такой регуляции приводит к возникновению различных заболеваний. Например, мутации генов, кодирующих рецепторы факторов роста, которые обладают тирозинкиназной активностью, могут сопровождаться неуправляемым делением клеток и злокачественным перерождением тканей.
Процессы апоптоза (программируемой гибели клеток) находятся под контролем нескольких групп протеинкиназ, и нарушение баланса приводит либо к преждевременной гибели клеток, либо к их злокачественному перерождению. Гиперфосфорилирование некоторых цитоскелетных белков ведёт к их агрегации и является одной из причин ряда нейродегенеративных заболеваний (например, болезни Альцгеймера).