Лимонная кислота
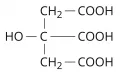
Лимо́нная кислота́ (3-гидрокси-3-карбоксипентандиовая кислота, 2-гидрокси-1,2,3-пропантрикарбоновая кислота), насыщенная алифатическая трёхосновная гидроксикислота, (HOOCCH2)2C(OH)COOH. Соли и эфиры лимонной кислоты называются цитратами. Очень широко распространена в природе, промежуточный метаболит цикла трикарбоновых кислот, глиоксилатного цикла, принимает участие в поддержании кислотно-основного и ионного равновесия в клетках. Некоторые растения и микроорганизмы способны накапливать лимонную кислоту. Впервые лимонную кислоту выделил в 1784 г. К. Шееле, осадив её из лимонного сока в виде цитрата кальция. Молярная масса 192,13 г/моль. Плотность 1,665 г/см3. Температура плавления 153,5 °C.
Физико-химические свойства
Лимонная кислота – бесцветное кристаллической вещество, хорошо растворимое в воде [146 г/100 мл (20 °C), 525 г/100 мл (100 °C)], этаноле [116 г/моль (25 °C)], диэтиловом эфире [2,25 г/100 мл (15 °C)]. Лимонная кислота кристаллизуется из водных растворов с одной молекулой воды, плотность моногидрата 1,542 г/см3, температура плавления ~ 100 °C, устойчив при температурах ниже 35,8 °C. Константы диссоциации кислоты (pKa) составляют 3,13, 4,76 и 6,40.
Лимонная кислота обладает свойствами карбоновых кислот и спиртов. Можно получить одно-, двух- и трёхзамещённые соли и эфиры лимонной кислоты. Лимонная кислота ацилируется по гидроксильной группе (-OH). Как гидроксикислота, образует стабильные циклические комплексные ионы (хелаты) с ионами металлов. Являясь одновременно α- и β-гидроксикислотой, при нагревании до 175 °C лимонная кислота образует аконитовую кислоту за счёт дегидратации и 3-кетоглутаровую кислоту в результате элиминирования муравьиной кислоты. Нагревание выше 175 °C приводит к образованию итаконовой кислоты. Нагревание с серной кислотой ведёт к декарбоксилированию и декарбонилированию лимонной кислоты.
Способы получения
Основной промышленный способ получения лимонной кислоты – сбраживание сахара, патоки или мелассы штаммами грибов Aspergillus niger. Лимонную кислоту также выделяют из растительного сырья.
Участие в обмене веществ
Лимонная кислота широко распространена в природе. Она является важным метаболитом обмена веществ у животных, растений и микроорганизмов, необходима для поддержания кислотно-основного и ионного равновесия в организмах. Цитрат является продуктом первой реакции цикла трикарбоновых кислот и глиоксилатного цикла, в ходе которой ацетил-производное кофермента А конденсируется с оксалоацетатом под действием цитратсинтазы (КФ 2.3.3.1). На следующей стадии происходит конверсия лимонной кислоты в изолимонную под действием аконитатгидратазы (КФ 4.2.1.3) через образование цис-аконитовой кислоты как промежуточного продукта.
Цитрат участвует в минерализации костной ткани (в ней находится около 90 % от его общего количества в организме), стимулирует синтез жирных кислот.
Некоторые растения могут накапливать лимонную кислоту [в соке плодов цитрусовых до 6–8% лимонной кислоты, в листьях махорки – 8–14% (от массы сухого вещества)]. Микроорганизмы при лимоннокислом брожении нарабатывают в культуральных жидкостях до 10% лимонной кислоты.
Применение
Лимонная кислота и её соли (пищевые добавки Е330 – Е333) широко применяются в пищевой промышленности в качестве регуляторов кислотности, антиокислителей, комплексообразователей, эмульгаторов и стабилизаторов, в фармацевтической промышленности в составе лекарственных средств (например, лимоннокислый натрий – антикоагулянт).
Лимонную кислоту применяют в электрохимической и нефтедобывающей отраслях. Хелатирующие свойства лимонной кислоты используются при очистке металлов, её вводят в состав поверхностно-активных веществ. Эфиры лимонной кислоты применяются в производстве пластмасс.