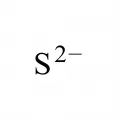Сульфиды
Сульфи́ды (от новолат. sulfur – сера), общее название химических соединений, содержащих серу в степени окисления –2. Могут рассматриваться как производные сероводородной кислоты H2S. Различают неорганические и органические сульфиды.
Неорганические сульфиды
Неорганические сульфиды – соединения S с более электроположительными элементами. Среди бинарных неорганических сульфидов выделяют средние M2Sn и кислые (гидросульфиды) M(HS)n соли сероводородной кислоты (M – электроположительный элемент, n – его степень окисления).
Неорганические сульфиды s-элементов – щелочных и щёлочноземельных металлов (ионно-ковалентный характер химической связи с преобладанием ионной составляющей) имеют относительно высокие температуры плавления, солеподобны, бесцветны, гигроскопичны, как правило, растворяются в воде, образуют кристаллогидраты, окисляются до сульфатов, легко разлагаются кислотами на холоде. Растворимые сульфиды щелочных и щёлочноземельных металлов при нагревании водных растворов присоединяют S с образованием полисульфидов.
Сульфиды d- и f-металлов (у низших химическая связь преимущественно металлического характера, у высших – ионно-ковалентного) – термически устойчивы, практически не растворяются в воде, разлагаются горячими концентрированными кислотами, бромной водой, царской водкой, окисляются при нагревании на воздухе до оксидов и осно́вных сульфатов.
Сульфиды p-элементов, а также близкие к ним ZnS, CdS, HgS, Cu2S, Ag2S (ковалентно-ионная химическая связь, вклад ковалентной составляющей повышается с увеличением номера группы) – химически нестойки, многие реагируют с H2O воздуха, легко разлагаются минеральными кислотами, быстро окисляются при нагревании на воздухе, в воде практически не растворяются.
Сульфиды щелочных, щёлочноземельных металлов, Mg, Al, Be – диэлектрики; сульфиды p-элементов, высшие сульфиды d- и f-элементов, Cu2S, Ag2S, ZnS, CdS, HgS – полупроводники; сульфиды железа – антиферро-, ферри- и ферромагнитны.
Сульфиды получают прямым взаимодействием простых веществ, реакцией H2S с металлами, их оксидами, гидроксидами или солями, восстановлением сульфатов металлов и др. Многие неорганические сульфиды встречаются в природе в виде минералов (аурипигмент, молибденит, пирит и др.).
Неорганические сульфиды используют в кожевенной промышленности, в производстве фрикционных материалов, как основу люминофоров и полупроводников, для борьбы с вредителями в сельском хозяйстве, как неорганические пигменты (литопон) и др. Сульфиды переходных металлов – в качестве катализаторов гидрирования и гидроочистки. Наноматериалы на основе сульфидов металлов находят применение в таких областях, как фотокаталитические технологии (разложение красителей), производство энергии (солнечные батареи), хранение энергии (суперконденсаторы; литий-, натрий-, магний-ионные аккумуляторы), биомедицина (фототермическая терапия опухолей).
Органические сульфиды
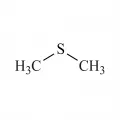 Структурная формула диметилсульфида.Органические сульфиды (тиоэфиры) – сераорганические соединения общей формулы RSR′ (R и R′ – одинаковые или разные opганические остатки; атом S может входить в цикл). Являются серосодержащими аналогами простых эфиров. Низшие алифатические органические сульфиды – подвижные бесцветные жидкости; не растворяются в воде, хорошо растворяются в органических растворителях (хлороформе, этаноле и др.) Окисляются пероксидом водорода H2O2 до сульфоксидов и сульфонов; c солями тяжёлых металлов, а также с кислотами Льюиса образуют комплексы; с алкилиодидами, диалкилсульфатами и алкилсульфонатами, а также со спиртами в присутствии кислот – соли сульфония. Большинство алкилсульфидов с низкой молекулярной массой обладают интенсивным неприятным запахом. Многие органические сульфиды токсичны (особенно галогенированные, например иприт), вызывают раздражение кожи и слизистых оболочек.
Структурная формула диметилсульфида.Органические сульфиды (тиоэфиры) – сераорганические соединения общей формулы RSR′ (R и R′ – одинаковые или разные opганические остатки; атом S может входить в цикл). Являются серосодержащими аналогами простых эфиров. Низшие алифатические органические сульфиды – подвижные бесцветные жидкости; не растворяются в воде, хорошо растворяются в органических растворителях (хлороформе, этаноле и др.) Окисляются пероксидом водорода H2O2 до сульфоксидов и сульфонов; c солями тяжёлых металлов, а также с кислотами Льюиса образуют комплексы; с алкилиодидами, диалкилсульфатами и алкилсульфонатами, а также со спиртами в присутствии кислот – соли сульфония. Большинство алкилсульфидов с низкой молекулярной массой обладают интенсивным неприятным запахом. Многие органические сульфиды токсичны (особенно галогенированные, например иприт), вызывают раздражение кожи и слизистых оболочек.
Получают: симметричные алкилсульфиды – взаимодействием алкилгалогенидов с Na2S, несимметричные – реакцией алкилгалогенидов с тиолатами металлов, присоединением H2S или тиолов к олефинам. Встречаются в природе (примеси в неочищенной нефти, биологически активные природные соединения биотин, метионин и др.)
Применяют в качестве одорантов горючих газов, антиоксидантов, стабилизаторов топлив, смазочных масел и полимеров, ингибиторов радикальных реакций. В виде структурных фрагментов входят в состав пестицидов, лекарственных средств и др. Диметилсульфид – сырьё для получения диметилсульфоксида, дивинилсульфид – мономер для получения ионообменных смол и адсорбентов.