Оксид цинка
Окси́д ци́нка (окись цинка), кислородное соединение металла цинка, ZnO. Является наиболее устойчивым оксидом цинка, в котором металл имеет степень окисления +2. Молярная масса 81,37 г/моль; плотность 5,67 г/см3. Температура плавления ~1975 °C (под избыточным давлением), при нагреве возгоняется.
Физико-химические свойства
Оксид цинка представляет собой преимущественно белый кристаллический порошок, что объясняется наличием в электронной структуре завершённого d-уровня (исключены d-d-переходы, которые ответственны за окраску соединений).
Фазовая диаграмма
Традиционная диаграмма состояния Zn – O не построена. На рис. 1 приведено (T, x) сечение фазовой диаграммы (Ellmer. 2008; Wriedt. 1987). До 200 °С вместе с оксидом цинка (гексагональная сингония, пространственная группа ) существует пероксид цинка ZnO2 (кубическая сингония, пространственная группа ). При более высоких температурах стабилен только ZnO (Wriedt. 1987). Для оксида цинка характерно повышенное давление пара ниже температуры плавления (склонен к сублимации), например давление при температуре ~1400 °С уже не позволяет выращивать монокристаллы из расплава (Anthrop. 1964).
 Рис. 1. Фазовая диаграмма бинарной системы Zn – O при давлении 0,1 МПа.Для оксида цинка характерна узкая область гомогенности. Положение границы области гомогенности со стороны цинка зависит от температуры: в интервале температур 700–1100 °С значение x в формуле Zn1 + xO увеличивается от 5,9 · 10–6 до 1,5 · 10–4 (Hagemark. 1975). При изменении степени отклонения от стехиометрии происходит изменение цвета оксида цинка: при избытке цинка – тёмно-красный, при избытке кислорода – светло-жёлтый.
Рис. 1. Фазовая диаграмма бинарной системы Zn – O при давлении 0,1 МПа.Для оксида цинка характерна узкая область гомогенности. Положение границы области гомогенности со стороны цинка зависит от температуры: в интервале температур 700–1100 °С значение x в формуле Zn1 + xO увеличивается от 5,9 · 10–6 до 1,5 · 10–4 (Hagemark. 1975). При изменении степени отклонения от стехиометрии происходит изменение цвета оксида цинка: при избытке цинка – тёмно-красный, при избытке кислорода – светло-жёлтый.
Кристаллическая структура
Оксид цинка при нормальных условиях преимущественно кристаллизуется в гексагональной структуре вюрцита (гексагональная сингония, голоэдрическая группа , подгруппа , пространственная группа симметрии , № 186, рис. 2).
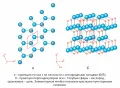 Рис. 2. Две проекции кристаллической структуры гексагонального оксида цинка.В гексагональной элементарной ячейке оксида цинка, содержащей 2 формульные единицы ZnO, атомы цинка тетраэдрически окружены атомами кислорода. Расстояния Zn – O вдоль оси c немного короче (dZn – O = 0,196 нм), чем расстояния до трёх других атомов кислорода (dZn – O = 0,198 нм) (Ellmer. 2010). Перпендикулярно кристаллографической оси c элементарная ячейка представляет собой двойные слои, состоящие из плоскостей атомов цинка и кислорода, которые можно рассматривать как структурные блоки вюрцита. В них реализуются 3 связи из 4 для каждого атома. Такая почти идеальная тетраэдрическая координация индуцирует полярную симметрию в кристалле оксиде цинка (Heiland. 1963), что объясняет наличие уникальных физико-химических свойств, например пьезоэлектрических, а также высокую эффективность легирования, сильно анизотропное травление. Например, экспериментально установлено, что поверхность , состоящая только из атомов кислорода, сильно травится даже в очень разбавленных кислотах, таких как HCl, H2SO4, HNO3, H3PO4, в то время как поверхность , которая представлена только цинковыми концевыми группами, довольно устойчива к действию этих кислот (Mariano. 1963).
Рис. 2. Две проекции кристаллической структуры гексагонального оксида цинка.В гексагональной элементарной ячейке оксида цинка, содержащей 2 формульные единицы ZnO, атомы цинка тетраэдрически окружены атомами кислорода. Расстояния Zn – O вдоль оси c немного короче (dZn – O = 0,196 нм), чем расстояния до трёх других атомов кислорода (dZn – O = 0,198 нм) (Ellmer. 2010). Перпендикулярно кристаллографической оси c элементарная ячейка представляет собой двойные слои, состоящие из плоскостей атомов цинка и кислорода, которые можно рассматривать как структурные блоки вюрцита. В них реализуются 3 связи из 4 для каждого атома. Такая почти идеальная тетраэдрическая координация индуцирует полярную симметрию в кристалле оксиде цинка (Heiland. 1963), что объясняет наличие уникальных физико-химических свойств, например пьезоэлектрических, а также высокую эффективность легирования, сильно анизотропное травление. Например, экспериментально установлено, что поверхность , состоящая только из атомов кислорода, сильно травится даже в очень разбавленных кислотах, таких как HCl, H2SO4, HNO3, H3PO4, в то время как поверхность , которая представлена только цинковыми концевыми группами, довольно устойчива к действию этих кислот (Mariano. 1963).
В литературных источниках значения параметра кристаллической решётки а варьируются от 3,2475 до 3,2501 Å, параметра с – от 5,2042 до 5,2075 Å, а соотношение – от 1,593 до 1,6035 Å (A comprehensive review of ZnO ... 2005). Данное соотношение несколько отклоняется от идеального значения для гексагональной структуры вюрцита, что объясняется устойчивостью получаемой искажённой кристаллической структуры и/или изменением степени ионности связи. Спектроскопические и термохимические исследования (Duffy. 2006) показывают, что степень ковалентности связи составляет 40–50 %.
Помимо гексагональной кристаллической решётки оксид цинка может образовывать ещё 2 известные структуры (рис. 3):
1) структура сфалерита, или цинковой обманки, с пространственной группой симметрии (кубическая сингония, голоэдрическая группа , подгруппа ), что соответствует тетраэдрическому окружению; координационные числа атомов цинка и кислорода равны 4. Данная фаза оксида цинка является метастабильной, монокристаллы с такой структурой оксида цинка не получены, но созданы плёнки на подложках с кубической структурой (Ashrafi. 2007);
2) структура хлорида натрия с пространственной группой симметрии (кубическая сингония, голоэдрическая группа , подгруппа ), которая соответствует октаэдрическому окружению; координационные числа атомов цинка и кислорода равны 6. Данная фаза получена при высоких давлениях ~9 ГПа и температуре 300 К (Electrical properties ... 1981).
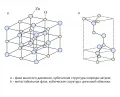 Рис. 3. Кристаллические структуры оксида цинка.
Рис. 3. Кристаллические структуры оксида цинка.
Термические свойства
Теплофизические свойства оксида цинка неодинаковы вдоль различных направлений (Ellmer. 2010). Так, теплопроводность составляет 69 (вдоль оси a) и 60 Вт · м–1 · К–1 (вдоль оси c), а коэффициент теплового расширения равен 2,92 · 10–6 (вдоль оси a) и 4,75 · 10–6 К–1 (вдоль оси c).
Оптические и электрофизические свойства
Оксид цинка является широкозонным полупроводником n-типа (Eg ~3,4 эВ) (Ellmer. 2011). Благодаря значительной энергии экситона (~60 мэВ) у оксида цинка наблюдается довольно интенсивное ультрафиолетовое излучение. У индивидуального кристаллического оксида цинка имеется 2 пика фотолюминесценции – при ~378 и ~562 нм (Construction of a Pt-modified chestnut-shell-like ZnO ... 2018; Ultraviolet emission in ZnO films ... 2004). Первый, наиболее интенсивный, относится к ближнему краю поглощения и соответствует активной рекомбинации свободных экситонов. Второй, менее интенсивный и более пологий, относится к зелёному в видимой области спектра рекомбинационному излучению электронно-дырочных пар («уровень дефектов») (Janotti. 2006). Наличие полос на длинах волн в видимой области спектра связывают с точечными дефектами структуры оксида цинка. Полоса фотолюминесценции при ~562 нм связана в большей степени с наличием кислородных вакансий. Поглощение в области ~650 нм, что соответствует красно-оранжевой люминесценции, обычно интерпретируют как поверхностные дислокации или дефекты типа цинковых междоузлий.
Химические свойства
Оксид цинка является типичным представителем амфотерных оксидов: практически нерастворим в воде, хорошо растворим в кислотах и щелочах:
.
Наиболее существенным признаком проявления амфотерности оксида цинка является способность к комплексообразованию, в том числе к образованию растворимых гидроксокомплексов в щелочных средах:
.
В результате комплексообразования оксид цинка растворяется в водном растворе аммиака с образованием катиона тетрааминцинка(II):
.
При температуре выше 1000 °С оксид цинка восстанавливается углеродом, угарным газом и водородом до металлического цинка:
,
,
.
При сплавлении оксид цинка взаимодействует с оксидами и карбонатами щелочных и щёлочноземельных металлов с образованием цинкатов, представляющих собой смешанные оксиды, поскольку в них отсутствуют структурные фрагменты ZnO22−:
,
,
.
При сплавлении с оксидами неметаллов образует соли, например при взаимодействии с оксидами бора и кремния образует стеклообразные бораты и силикаты по следующим реакциям:
,
.
Твёрдый оксид цинка, в отличие от многих других оксидов, может взаимодействовать с газообразным хлором в отсутствие восстановителя (температура начала реакции 300 °С с резким возрастанием скорости реакции при 600 °С):
Однако хлорирование водной суспензии протекает по реакции:
.
Раствор может быть очищен от хлората цинка кипячением с хлоридом калия, после охлаждения выпадает в осадок малорастворимый хлорат калия.
При повышенной температуре (450–550 °С) реагирует с сероводородом с образованием сульфида цинка:
.
Данный процесс наблюдается и при меньших температурах (модификация поверхности ZnO), что значительно влияет на электропроводность материала.
Нахождение в природе
Оксид цинка встречается в природе в виде редкого минерала цинкита, окрашенного в красный или оранжевый цвет, с примесями марганца или железа (рис. 4). Цинкит был открыт в 1810 г. американским минералогом А. Брюсом на месторождении Франклин (г. Франклин, Нью-Джерси, США) и назван красным оксидом цинка (Bruce. 1810); переименован в 1845 г. немецким минералогом В. К. фон Хайдингером (Haidinger. 1845).
 Рис. 4. Минерал цинкит.Сообщается о местонахождениях цинкита в Саравецце (Тоскана, Италия), Цумебе (Намибия), Олькуше (Польша), Испании, Тасмании и Австралии. На территории России встречается на Дукатском месторождении (Магаданская область) и в Забайкалье (в Бурятии).
Рис. 4. Минерал цинкит.Сообщается о местонахождениях цинкита в Саравецце (Тоскана, Италия), Цумебе (Намибия), Олькуше (Польша), Испании, Тасмании и Австралии. На территории России встречается на Дукатском месторождении (Магаданская область) и в Забайкалье (в Бурятии).
Получение
Оксид цинка можно синтезировать из простых веществ, распыляя порошок металлического цинка в пламени горелки, при этом происходит следующая реакция:
.
Металлический цинк также реагирует с образованием оксида цинка под воздействием диоксида углерода и паров воды при температурах выше 800 и 600 °С соответственно (Лидин. 2015):
,
.
Кроме этого, используют термолиз гидроксидов, карбонатов или нитратов:
,
,
.
В промышленности оксид цинка получают пирометаллургическим методом, основанным на полном окислении сульфида цинка:
.
Безопасность
Оксид цинка малотоксичен, однако в виде мелкодисперсной пыли может вызывать механическое раздражение глаз и дыхательных путей. Вдыхание испарений оксида цинка является распространённой причиной литейной лихорадки (Оксид цинка).
Применение
Благодаря уникальному набору физико-химических свойств (способность к поглощению УФ-излучения, хорошая электропроводность, оптическая прозрачность, низкая токсичность в форме кристаллического порошка и др.) оксид цинка является многофункциональным материалом и широко применяется в различных областях промышленности, науки и техники.
В промышленности оксид цинка используется при производстве резины (сокращает время вулканизации); в качестве белого пигмента, т. н. цинковые белила (обладая устойчивостью к действию соединений серы и меньшей токсичностью, заменили свинцовые белила – карбонат свинца); в качестве добавки при производстве стёкол (увеличивает срок эксплуатации стекла), отвердителей, стабилизаторов пластмасс и фунгицидов. Применяется в фармацевтике и косметике (поглотитель УФ-излучения) при производстве различных препаратов (мази, пасты, присыпки при кожных заболеваниях и др.) и мыла. В медицине быстротвердеющая смесь оксида цинка с концентрированным раствором хлорида цинка является основой для стоматологического цемента, а также для специальных покрытий, не меняющих свой объём при затвердевании. Применяется в качестве материала для биосенсоров благодаря своей биосовместимости, химической стабильности, высокой изоэлектрической точке, электрохимической активности, высокой подвижности электронов и другим свойствам (Recent advances in ZnO nanostructures ... 2012).
Полупроводниковые и оптические свойства позволяют использовать плёнки на основе оксида цинка в фотодетекторах, солнечных элементах, тонкоплёночных транзисторах, фотогальванике, а также при производстве плоских дисплеев и в пьезоэлектрических устройствах. Оксид цинка применяется в катализе и фотокатализе, например при десульфировании пропилмеркаптана и гидрировании CO и СO2 (Хемосорбционно-каталитические свойства оксида цинка ... 2023; Особенности гидрирования CO2 ... 2022). Кроме того, оксид цинка является одним из наиболее широко используемых чувствительных материалов в составе хеморезистивных газовых сенсоров благодаря своей химической и термомеханической стабильности, а также улучшенным газочувствительным свойствам (Gas’kov. 2000; Active Sites on the Surface ... 2017; Zinc oxide obtained by the solvothermal method ... 2020; Gas-sensitive nanostructured ZnO films ... 2022).
